
- •1. Строение атома. Строение электронной оболочки атома. Связь строения и химических свойств атома.
- •2. Химическая связь. Строение молекулы.
- •3.Периодический закон д.И. Менделеева. Физический смысл констант в таблице д.И. Менделеева.
- •4. Основы термодинамики. Понятие внутренней энергии, энтальпии. 1 закон термодинамики. Закон Гесса. Следствие из закона Гесса.
- •5. Функции состояния системы: энтропия, энергия Гиббса. Определение направления протекания реакции.
- •6. Кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной среде.
- •7. Зависимость скорости реакции от температуры. Катализ. Виды катализа.
- •8. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •9.Растворы. Процесс растворения. Концентрация раствора. Классификация растворов.
- •10. Свойства растворов неэлектролитов. 1 и 2 закон Рауля. Осмотическое давление.
- •12. Ионное произведение воды, pH растворов.
- •13. Ионообменные процессы. Равновесие в водных растворах электролитов.
- •14. Гидролиз солей. Классификация солей по реализации процесса гидролиза. Гидролиз солей по катиону.
- •15. Гидролиз солей по аниону. Степень гидролиза. Влияние условий на степень гидролиза.
- •16. Поверхностные явления. Дисперсные системы. Классификация дисперсных систем.
- •17. Поверхностные явления. Сорбция.
- •18. Дисперсные системы. Коллоидные системы. Классификация.
- •19.Методы получения коллоидных систем. Пептизация. Устойчивость коллоидных систем. Коагуляция.
- •20. Строение мицеллы, образованной в результате реакции обмена
- •21. Овр. Степень окисления элемента. Составление уравнений овр.
- •22. Важнейшие окислители и восстановители. Роль соединения в овр, исходя из степени окисления элемента.
- •23. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Зависимость химической активности металла от значения потенциала. Взаимодействие металлов с солями и кислотами.
- •24. Уравнение Нернста. Гальванические элементы. Эдс гальванического элемента.
- •25. Коррозия металлов. Основные виды и типы коррозии металлов, их характеристика.
- •26. Методы защиты металлов от коррозии.
- •27. Электролиз расплава. Электролиз раствора соли с нерастворимым анодом. Катодные процессы. Порядок восстановления ионов из водных растворов солей.
- •28. Электролиз с активным анодом. Анодные процессы.
- •29. Качественный и количественный анализ вещества. Качественне реакции на катионы и анионы.
- •30. Физико-химические методы анализа (ма): электрохимические, спектральные (оптические), хроматографические, радиометрические, масс-спектрические.
- •31. Общая характеристика металлов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений. S-элементы, их общие характеристики.
- •32. Кальций и магний. Природные соединения. Соединения кальция и магния применяемые в строительстве.
- •33. Природные воды, их состав и классификация.
- •34. Жесткость воды. Классификация жесткости. Способы устранения.
- •36. Общая характеристика неметаллов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений на примере углерода и кремния.
- •37. Полимеры. Классификация полимеров. Особенности свойств полимеров в отличие от низкомолекулярных соединений.
- •38. Методы получения полимеров (реакция полимеризации и поликонденсации)
- •39. Понятие о физических состояниях полимеров. Переход полимера из одного физического состояния в другое.
- •40. Химические реакции в полимерах. Реакции отверждения. Деструкция полимеров.
38. Методы получения полимеров (реакция полимеризации и поликонденсации)
Полимеризация – это химический процесс, когда молекулы мономера присоединяются друг к другу за счет разрыва кратных связей или раскрытия циклов. Механизм полимеризации включает в себя ряд связанных стадий: -инициирование – зарождение активных центров полимеризации: М→М* -рост (продолжение) цепи – процесс последовательного присоединения молекул мономеров к центрам: М*+М→ММ*; ММ*+М→МММ* и т.д. -передача цепи – переход активного центра на другую молекулу -разветвление цепи – образование нескольких активных центров из одного -обрыв цепи – гибель активных центров: М* +МnМ*→Мn +2 Поликонденсация – это реакция м/у мономерами, протекающая за счёт взаимодействия ф-ых групп приводящая к образованию макромолекул и сопровождающаяся выделением простейших низкомолекулярных веществ (HCl, NH3, CH3OH, но чаще – воды). Примеры: -получение капрона из ε-аминокапроновой кислоты: nH2N-(CH2)5-COOH→H-[-NH-(CH2)5-CO-]n-OH+(n-1)H2O; -получение лавсана из терефталевой кислоты и этиленгликоля: nHOOC-C6H4-COOH+nHO-CH2CH2-OH→HO-(-CO-C6H4-CO-O-CH2CH2-O-)n-H+(n-1)H2O
Поликонденсация является основным способом образования природных полимеров в естественных условиях.
39. Понятие о физических состояниях полимеров. Переход полимера из одного физического состояния в другое.
Известны
три основных агрегатных состояния
веществ — твердое, жидкое и газообразное.
В основу такой классификации положена
способность тел сохранять свой объем
и форму, а также способность сопротивляться
воздействию внешних сил. Цепное строение
и гибкость макромолекул ответственны
за то, что полимеры могут находиться
только в жидком или твердом агрегатном
состоянии. Газообразное состояние для
них невозможно. Твёрдый полимер может
быть кристаллическим или аморфным.
Кристаллические полимеры – это такие,
у которых есть трёхмерный дальний
порядок в расположении макромолекул и
кристаллическая решётка; для них
характерен только опр-ый уровень
кристалличности. У аморфных же полимеров
нет кристаллической решётки, но есть
ближний порядок в расположении звеньев
или сегментов макромолекул. Для аморфных
полимеров в зависимости от температуры
характерны три физических состояния —
стеклообразное, высокоэластичное и
вязкотекучее.
Стеклообразное
состояние (основное
состояние, используемое в производстве).
Характерны:
-высокая плотность
упаковки макромолекул
-сильно
ограниченная сегментная подвижность
макромолекул
-незначительная
(несколько %) упругая деформация
-невысокий
t-ый
к-т расширения
-неравновесная структура
(чем выше v
стеклования, тем более неравновесная
структура); при последующем охлаждении
структура изменяется в сторону
равновесной, что может сопровождаться
повышением
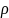 и уменьшением V.
Высокоэластичное
состояние.
Характерно:
-способность к очень
большим обратимым деформациям (сотни
%) под действием малых напряжений
-достаточно
высокая плотность упаковки макромолекул,
но менее, чем у стеклообразного
-высокая
подвижность сегментов макромолекул,
позволяющая им менять конформацию
(форму)
Вязкотекучее
состояние.
Характерно:
-деформация течения под
влиянием напряжения (при это реализуется
необратимое перемещение макромолекул
относительно друг друга)
-очень
высокая подвижность сегментов
-плотность
упаковки макромолекул ниже, чем в
высокоэластичном состоянии
-структура
расплава имеет ближний порядок.
Фазовые
переходы
Каждое
физическое состояние характеризуется
определенным комплексом деформационных
свойств, знание которых очень важно как
при переработке полимеров, так и при
эксплуатации изделий из них. Из одного
физического состояния в другое полимер
переходит в некотором диапазоне t-р.
t-ра
перехода – средняя t-ра
даипазона.
t-ра
стеклования (TС)
– t-ра
перехода из эластичного состояния в
стеклообразное.
t-ра
текучести (TT)
– t-ра
перехода из эластичного состояния в
вязкотекучее.
и уменьшением V.
Высокоэластичное
состояние.
Характерно:
-способность к очень
большим обратимым деформациям (сотни
%) под действием малых напряжений
-достаточно
высокая плотность упаковки макромолекул,
но менее, чем у стеклообразного
-высокая
подвижность сегментов макромолекул,
позволяющая им менять конформацию
(форму)
Вязкотекучее
состояние.
Характерно:
-деформация течения под
влиянием напряжения (при это реализуется
необратимое перемещение макромолекул
относительно друг друга)
-очень
высокая подвижность сегментов
-плотность
упаковки макромолекул ниже, чем в
высокоэластичном состоянии
-структура
расплава имеет ближний порядок.
Фазовые
переходы
Каждое
физическое состояние характеризуется
определенным комплексом деформационных
свойств, знание которых очень важно как
при переработке полимеров, так и при
эксплуатации изделий из них. Из одного
физического состояния в другое полимер
переходит в некотором диапазоне t-р.
t-ра
перехода – средняя t-ра
даипазона.
t-ра
стеклования (TС)
– t-ра
перехода из эластичного состояния в
стеклообразное.
t-ра
текучести (TT)
– t-ра
перехода из эластичного состояния в
вязкотекучее.
