
- •1. Фотоэффект.
- •2. Эффект Комптона.
- •3. Поляризация фотонов. Интерференция фотонов.
- •4. Дифракция рентген-х лучей в кристаллах. Методы исслед дифракции: способы Лауэ, Брэгга и Дебая-Шерера.
- •5 . Эффект Рамзауэра – Таунсенда.
- •6.Понятие волн де Бройля. Уравнения де Бройля. Эксперименты по волновой природе элементарных частиц
- •Эксперименты по волновой природе элементарных частиц.
- •7. Законы излучения абсолютно черного тела, формула Планка.
- •8. Опыт Франка-Герца. Атомные спектры.
- •9 . Опыты Резерфорда Ядерная модель атома.
- •10. Постулаты Бора...
- •11. Спектральн. Линии. Изотопический сдвиг спектр. Линий.
- •13. Постулаты квантовой механики и описание динамических переменных с помощью операторов.
- •14. Квантовомеханические операторы, их свойства, собственные значения и собственные функции.
- •15. Условие одновременной измеримости различных динамических переменных. Соотношение неопределенностей.
- •16. Частица в одномерной прямоугольной потенциальной яме с абсолютно непроницаемыми стенками.
- •17.Частица в одномерной прямоугольной потенциальной яме конечной глубины
- •1 8.Прохождение частицы сквозь потенциальный барьер(туннельный эффект)
- •19. Контактная разность потенциалов, эффект холодной эмиссии электронов, альфа – распад.
- •20. Уравнение Шредингера для атома водорода, собственные значения и собственные функции угловой части.
- •21. Атом водорода, собственное значение и собственная ф-я радиальной части ур-я Шредингера
- •22. Уравнение Шредингера для атомов щелочных метало, собственные значения и энергии.
- •23. Спектральные серии щелочных атомов, правила отбора
- •24. Дублетный характер спектров щелочных металлов. Спин эл-на, спин-орбитальное взаимодействие.
- •25. Маг и мех моменты электрона. Правило квантования.
- •26. Маг и мех момент атома. Векторная модель атома. Jj и l-s связь…
- •27.Эффект Зеемана.
- •28.Эффект Пашена-Бака.
- •31.Электронные конфигурации, принципы заполнения электронных оболочек атомов, правило Хунда.
- •32. Рентгеновские спектры.
22. Уравнение Шредингера для атомов щелочных метало, собственные значения и энергии.
Д![]() ля
атома водорода нахождение уровней
энергий является несложной аналитической
задачей. Если в атоме существуют
несколько электронов, то решение
уравнения Шредингера существенно
усложняется. В настоящее время ни
точного аналитического, ни точного
численного решения ещё не получено.
Существуют лишь приближённые решения.
Щелочные металлы в таблице Менделеева
следуют за благородными газами, то есть
их атомы содержат на один электрон
больше, чем атомы инертных газов. Поэтому
эти металлы легко ионизировать.
Энергетическое строение атомов щелочных
металлов близко к строению атома
водорода. Если атом щелочного металла
имеет Z электронов, то Z-1 электрон
образуют структуру, схожую с атомом
инертного газа, называемую атомным
остовом. Связь последнего электрона с
остовом слабая, поэтому можно считать,
что валентный электрон движется в
эффективном поле атомного остова.
Однако валентный электрон деформирует
оболочку и искажает потенциальное поле
кулоновских сил, в котором сам же и
двигается. Поэтому потенциальная
энергия валентного электрона моет быть
представлена в виде:
ля
атома водорода нахождение уровней
энергий является несложной аналитической
задачей. Если в атоме существуют
несколько электронов, то решение
уравнения Шредингера существенно
усложняется. В настоящее время ни
точного аналитического, ни точного
численного решения ещё не получено.
Существуют лишь приближённые решения.
Щелочные металлы в таблице Менделеева
следуют за благородными газами, то есть
их атомы содержат на один электрон
больше, чем атомы инертных газов. Поэтому
эти металлы легко ионизировать.
Энергетическое строение атомов щелочных
металлов близко к строению атома
водорода. Если атом щелочного металла
имеет Z электронов, то Z-1 электрон
образуют структуру, схожую с атомом
инертного газа, называемую атомным
остовом. Связь последнего электрона с
остовом слабая, поэтому можно считать,
что валентный электрон движется в
эффективном поле атомного остова.
Однако валентный электрон деформирует
оболочку и искажает потенциальное поле
кулоновских сил, в котором сам же и
двигается. Поэтому потенциальная
энергия валентного электрона моет быть
представлена в виде:![]() .
Здесь слагаемые со степенью -2 и выше
образуют поправку на влияние на искажение
поля электроном. Ограничимся поправкой
пропорциональной 1/r2. Тогда уравнение
Шредингера для радиальной части волновой
функции примет вид:
.
Здесь слагаемые со степенью -2 и выше
образуют поправку на влияние на искажение
поля электроном. Ограничимся поправкой
пропорциональной 1/r2. Тогда уравнение
Шредингера для радиальной части волновой
функции примет вид:
 .
Данное уравнение будет полностью
совпадать с уравнением Шредингера,
которое мы уже решили, если положить
.
Данное уравнение будет полностью
совпадать с уравнением Шредингера,
которое мы уже решили, если положить![]() .
Раскрыв скобки и решив полученное
квадратное уравнение относительно l’,
получим:
.
Раскрыв скобки и решив полученное
квадратное уравнение относительно l’,
получим:![]() ;
;![]() .
Здесь l’ должно быть больше нуля, иначе
угловая часть волновой функции будет
бесконечна. Тогда
.
Здесь l’ должно быть больше нуля, иначе
угловая часть волновой функции будет
бесконечна. Тогда![]() .
Так как электрон не очень сильно искажает
кулоновское поле, то в подкоренном
выражении можно разложить в ряд второе
слагаемое, так как оно гораздо меньше
единицы. Ограничимся только первым
слагаемым:
.
Так как электрон не очень сильно искажает
кулоновское поле, то в подкоренном
выражении можно разложить в ряд второе
слагаемое, так как оно гораздо меньше
единицы. Ограничимся только первым
слагаемым:
 .
Тогда
.
Тогда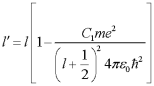 .
Размерность C1 – метр.
.
Размерность C1 – метр. ,
но
,
но
![]() – радиус первой боровской орбиты.
Тогда
– радиус первой боровской орбиты.
Тогда![]() .
Здесь
.
Здесь
 – среднее расстояние от ядра до
ближайшего электрона имеет порядок
10-11м. Таким образом, поправка действительно
мала. Тогда для атома щелочного металла
главное квантовое число будет:
– среднее расстояние от ядра до
ближайшего электрона имеет порядок
10-11м. Таким образом, поправка действительно
мала. Тогда для атома щелочного металла
главное квантовое число будет: .
Введём обозначение:
.
Введём обозначение: .
Следовательно,
.
Следовательно,
 .
Тогда выражение для уровней энергии
щелочного металла примет вид:
.
Тогда выражение для уровней энергии
щелочного металла примет вид:
 ,
где
,
где
 ,
а Z – заряд ядра.
,
а Z – заряд ядра.
Рассмотрим
энергетическую структуру Li. Литий –
щелочной металл. В таблице Менделеева
он идёт сразу за инертным газом гелием,
поэтому имеет соответственно на один
электрон больше, чем He. Литий обладает
тремя электронами, два из которых
образуют вместе с ядром устойчивую
структуру, – атомный остов, а на внешнем
энергетическом уровне расположен лишь
один валентный электрон. Главное
квантовое число лития в основном
состоянии равно двум: n=2; основное
состояние – 2S. Рассмотрим главное
квантовое число:
 .
Тогда, если k=0, то
.
Тогда, если k=0, то
 .Тогда
l в состоянии 2S равно 0, но из последней
формулы следует, что l может быть также
равно 1. Это даёт состояние 2p. Энергия
в этом состоянии больше, чем для случая
j=0, так как
.Тогда
l в состоянии 2S равно 0, но из последней
формулы следует, что l может быть также
равно 1. Это даёт состояние 2p. Энергия
в этом состоянии больше, чем для случая
j=0, так как![]() ,
,
![]() здесь меньше нуля. Очевидно, что для
n=2
здесь меньше нуля. Очевидно, что для
n=2
 ,
поэтому состояние 2d невозможно.
Невозможны также состояния 2f и 3f.
Переходы между различными состояниями
осуществляются по правилам отбора: в
атоме возможны только те оптические
переходы, в которых дипольный момент
перехода не равен нулю. Под дипольным
моментом D понимают переход между
квантовыми уровнями с числами m и n:
,
поэтому состояние 2d невозможно.
Невозможны также состояния 2f и 3f.
Переходы между различными состояниями
осуществляются по правилам отбора: в
атоме возможны только те оптические
переходы, в которых дипольный момент
перехода не равен нулю. Под дипольным
моментом D понимают переход между
квантовыми уровнями с числами m и n:
 ,
где rm,rn –
,
где rm,rn –
Правило
отбора:
 принимает любое значение, а
принимает любое значение, а
 – только
– только
 .
В соответствии с данным правилом, для
лития существует переход из 2Sв p
состояния. Такой переход называют
главным, а спектральные линии, полученные
при таком переходе – главной серией:
.
В соответствии с данным правилом, для
лития существует переход из 2Sв p
состояния. Такой переход называют
главным, а спектральные линии, полученные
при таком переходе – главной серией:
 .
Для лития:
.
Для лития:
 .
Не запрещённые правилами отбора переходы
.
Не запрещённые правилами отбора переходы
 ,
,
 дают группу спектральных линий,
соответствующую этим переходам, которую
называют резкой серией. Не запрещены
также переходы
дают группу спектральных линий,
соответствующую этим переходам, которую
называют резкой серией. Не запрещены
также переходы
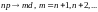 .
Для лития n=2; для натрия n=3. Данные
переходы образуют диффузную серию.
.
Для лития n=2; для натрия n=3. Данные
переходы образуют диффузную серию.
