
- •1. Фотоэффект.
- •2. Эффект Комптона.
- •3. Поляризация фотонов. Интерференция фотонов.
- •4. Дифракция рентген-х лучей в кристаллах. Методы исслед дифракции: способы Лауэ, Брэгга и Дебая-Шерера.
- •5 . Эффект Рамзауэра – Таунсенда.
- •6.Понятие волн де Бройля. Уравнения де Бройля. Эксперименты по волновой природе элементарных частиц
- •Эксперименты по волновой природе элементарных частиц.
- •7. Законы излучения абсолютно черного тела, формула Планка.
- •8. Опыт Франка-Герца. Атомные спектры.
- •9 . Опыты Резерфорда Ядерная модель атома.
- •10. Постулаты Бора...
- •11. Спектральн. Линии. Изотопический сдвиг спектр. Линий.
- •13. Постулаты квантовой механики и описание динамических переменных с помощью операторов.
- •14. Квантовомеханические операторы, их свойства, собственные значения и собственные функции.
- •15. Условие одновременной измеримости различных динамических переменных. Соотношение неопределенностей.
- •16. Частица в одномерной прямоугольной потенциальной яме с абсолютно непроницаемыми стенками.
- •17.Частица в одномерной прямоугольной потенциальной яме конечной глубины
- •1 8.Прохождение частицы сквозь потенциальный барьер(туннельный эффект)
- •19. Контактная разность потенциалов, эффект холодной эмиссии электронов, альфа – распад.
- •20. Уравнение Шредингера для атома водорода, собственные значения и собственные функции угловой части.
- •21. Атом водорода, собственное значение и собственная ф-я радиальной части ур-я Шредингера
- •22. Уравнение Шредингера для атомов щелочных метало, собственные значения и энергии.
- •23. Спектральные серии щелочных атомов, правила отбора
- •24. Дублетный характер спектров щелочных металлов. Спин эл-на, спин-орбитальное взаимодействие.
- •25. Маг и мех моменты электрона. Правило квантования.
- •26. Маг и мех момент атома. Векторная модель атома. Jj и l-s связь…
- •27.Эффект Зеемана.
- •28.Эффект Пашена-Бака.
- •31.Электронные конфигурации, принципы заполнения электронных оболочек атомов, правило Хунда.
- •32. Рентгеновские спектры.
11. Спектральн. Линии. Изотопический сдвиг спектр. Линий.
Все спектры (испускания, поглощения) делятся на линейчатые, полосатые и сплошные. Чем проще структура вещества, тем разрежённей его спектр. С другой стороны, чем меньше электронов содержит вещество, тем проще его спектр. Линейчатые спектры характерны для атомов определённых веществ. Полосатые спектры дают молекулы газа в разряженном состоянии. Сплошным спектром обладает газ при высокой температуре или жидкость, а также твёрдые тела.
Проведя
исследования было обнаружено: что
спектральные линии объединяются в
серии. Серией называется группа
спектральных линий, соответствующая
переходу атома с одного и того же
энергетического уровня на какой-либо
другой (для спектра испускания) либо в
одно и то же энергетическое состояние
(для спектра поглощения). Первая
спектральная серия для атома водорода
была обнаружена Бальмером и получила
его имя. Изучая спектр атома водорода
в видимой области, Бальмер получил
формулу:
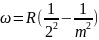 где
m=1, 2, 3…. Впоследствии были открыты и
остальные серии для атома водорода:
где
m=1, 2, 3…. Впоследствии были открыты и
остальные серии для атома водорода:
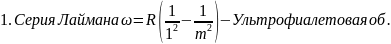
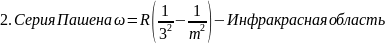


Расстояния между спектральными линиями с увеличением числа m становится всё меньше и меньше. Это утверждение очевидно следует из приведённых выше формул. Обобщая, можно записать закон построения спектральных линий для атома водорода для всех серий:

Причём
n определяет номер спектральной серии.
 для спектра испускания;
для спектра испускания;
 для
спектра поглощения. Введём
для
спектра поглощения. Введём
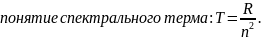
Таким
образом, частота любой спектральной
линии определяется
 Этот
принцип называют комбинационным
принципом Ритца: всё многообразие
спектральных линий одноэлектронного
атома является комбинацией спектральных
термов. Частота излучённой электромагнитной
волны при переходе атома с одного
энергетического уровня на другой
определяется формулой:
Этот
принцип называют комбинационным
принципом Ритца: всё многообразие
спектральных линий одноэлектронного
атома является комбинацией спектральных
термов. Частота излучённой электромагнитной
волны при переходе атома с одного
энергетического уровня на другой
определяется формулой:

уровней.
Таким образом, сравнение формул (1) и
(2) даёт, что физический смысл терм есть
отношение энергии уровня к постоянной
Планка. Следует отметить, что принцип
Ритца справедлив только для определённого
ряда атомов, у которых на внешней
оболочке либо один электрон, либо одного
нет. Это – так называемые водородоподобные
атомы. К их числу принадлежат ионы,
щелочные металлы и т. д. В данном случае

В спектре атома других линий быть не может, тем не менее, не все линии, определяемые комбинационным принципом Ритца, обязательно присутствуют в спектре, так как не нулевой вероятностью обладают лишь переходы, удовлетворяющие правилам отбора.Изотопами наз. элементы, заряд ядра к-ых одинаков, а массы различны. Химические св-ва изотопов весьма близки др. к др.
Дейтрон – ядро атома дейтерия, состоит из протона и нейтрона. Тритон – ядро атома трития, состоит из протона и 2-х нейтронов. Различие в массах ядер различных изотопов приводит к сдвигу линий др. относительно др. в их спектрах излучения – изотопический сдвиг. Он не велик. Например для
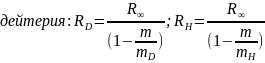
По сдвигу этих линий можно определить массу изотопа, по интенсивности – концентрацию изотопа.Две собственные ф-ции, принадлежащие различным собственным значениям, ортогональны друг другу т.е. интеграл от произведения одной из этих ф-ций на ф-цию, комплексно сопряженную с другой, взятый по всей области интегрирования равен нулю.
12. Ур-ие Шрёдингера как основа квантово-механического описания дискретных состояний атомов. Собственные значения и собственные ф-ии этого ур-ия, их свойства.
Из основных ур-ий электромагнитного поля вытекает волновое ур-ие для электромагнитных волн. Записываем и подставляем в него решение в виде плоских волн получим соотношение между частотой и составляющими волнового вектора (закон дисперсии):

Из
соотношений между импульсом и энергией
ньютоновской
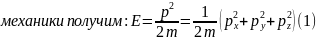
Воспользуемся квантовыми соотношениями для энергии и составляющих импульса:

Подставляя
их в (1), сокращая на
 получим:
получим:

- закон дисперсии волн де Бройля в нерелятивистском приближении. Далее возьмем формулу плоской волны де Бройля и продифференцировав ее 1 раз во времени и 2 по всеми координатам получим:
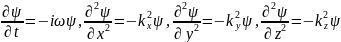
Найдя
отсюда
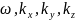 и подставив в закон дисперсии (2):
и подставив в закон дисперсии (2):
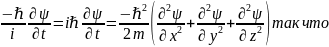

Для
стоячих монохроматических волн решение
может быть представлено в виде
произведения 2-х ф-ий, одна из к-ых ф-ия
координат, другая - ф-ия времени,
зависимость от времени
 .
Для таких решений левая часть (3) дает:
.
Для таких решений левая часть (3) дает:
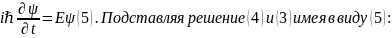

Частицы.
Обобщим его на случай частицы, движущейся
в силовом поле, характеризуемом
потенциальной энергией U. Полная энергия
равна
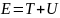 .
Для случая движения в поле с потенциальной
энергией мы должны подставить вместо
E в (6) кинетическую энергию
.
Для случая движения в поле с потенциальной
энергией мы должны подставить вместо
E в (6) кинетическую энергию
 и ур-е примет вид:
и ур-е примет вид:
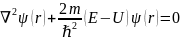
На приведенные соображения следует смотреть как на соображения, поясняющие установление ур-ия Шредингера, а не как вывод его. Вообще это ур-е строго вывода не имеет, оно устанавливается, и правильность его подтверждается согласием с опытом получаемых с его помощью результатов.
Свидетельством квантового характера ур-я Шредингера явл. Присутствие в нём постоянной Планка . Ур-е Шредингера записывается в 2-х наиболее распространённых формах.
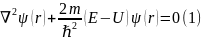
-
эта форма наиболее удобна для нахождения
ф-ии
 как решение дифференциального ур-я.
Другая форма записи:
как решение дифференциального ур-я.
Другая форма записи:
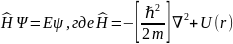
Более удобна для исследования принципиальных вопросов квантовой механики и обобщения ур-я Шредингера.
Еще есть ур-е Шредингера зависящее от времени:
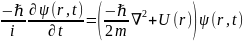
Ур-е
Шредингера имеет решение не при любых
значениях Е, а лишь при некоторых, к-ые
обозначаем
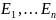 .
Значение Е при к-ых (1) имеет решение
обладающее указанными свойствами, т.е.
наз. собственными значениями, а функции
.
Значение Е при к-ых (1) имеет решение
обладающее указанными свойствами, т.е.
наз. собственными значениями, а функции
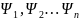 явл. Решением ур-ия (1) при
явл. Решением ур-ия (1) при
 собственными ф-ями, принадлежащими
собственным значениям
.
собственными ф-ями, принадлежащими
собственным значениям
.
