
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
Комплексными соединениями называют такие вещества, молекула которых состоит из центрального атома (иона), связанного с определенным числом n других молекул (ионов), называемых лигандами.
Теория Вернера:
В каждой комплексной молекуле есть центральный атом комплексообразователь, которыми чаще всего бывают катионы металлов или атомы металлов.
Вокруг комплексообразователя координируются молекулы или ионы. Одни из них располагаются непосредственно около центрального атома и представляют собой внутреннюю сферу. Другие формируют внешнюю сферу.
Ионы или молекулы, занимающие внутреннюю сферу, называются лигандами.
Ионы, находящиеся во внешней сфере, связаны с комплексообразователем ионной связью. Поэтому в воде происходит их диссоциация.
Координационное число – число всех связей комплексообразователя со своими лигандами. Координатное число определяется зарядом, размерами, строение электрической конфигурации комплексообразователя и лиганда.
Названия комплексных соединений образуют, называя сначала анион в миенительном падеже, а затем катион в родительном падеже. В комплексном соединении сначала называют лиганды - ионы, давая им окончание «о», затем называют лиганды – нейтральные молекулы.
Пример: дигидроксотетрахромплатинат (IV) аммония.
Общая формула комплексных соединений: [M(L)n]z-nx, Mz+ - атом комплексообразователь, Lх- - лиганд.
В реакции комплексообразователя лиганды являются основаниями Льюиса. В ходе реакции комплексообразования происходит перенос электронной пары, т.е. образование ковалентной связи по донорно-акцепторному механизму:
Mz+ +nLx- = [M(L)n]z-nx
Дентатность – число донорных атомов лиганда, способных одновременно принимать участие в координации.
Лиганды, образующие только одну σ-связь с атомом –комплексообразователем, называют монодентатными. (Дентантность – от лат. имеющий зубы). Монодентантные лиганды могут «укусить» комплексообразователь только одним «зубом», т.е образовать одну связь. Координационное число комплексообразователя равно числу лигандов только в том случае, если все лиганды монодентанты.
Если 2 связи, то лиганды называются бидентантными. Аналогично тридентантные, тетрадентантные и полидентантные лиганды.
18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
Геометрическая форма комплексных молекул и ионов описывается с помощью метода валентных связей. Пространственное строение комплекса определяется типом гибридизации атомных орбиталей центрального атома. Для описания геометрии комплексных соединений пользуются понятием координационных полиэдров (многогранников). Координационным полиэдром называют многогранник.ю вершинами которого служат лиганды, связанные с центральным атомом-комплексообразователем. Число вершин равно координационному числу, а его ребрами являются отрезки прямых, попарно соединяющих лиганды.
Комплексы с координационным числом 4 имеют форму тетраэдра или плоскоквадратную форму. Тетраэдрическая конфигурация обуславливается sp3 – гибридизацией. Планарная квадратная – dsp2.
Комплексы с координационным числом 6 имеют октаэдрическую конфигурацию, обусловленную d2sp3 – гибридизацией.
Комплекс имеет вид: [M(L)n]z-nx
Если z-nx > 0,то комплексная частица называется катионным комплексом.
Если z-nx<0, то это анионный комплекс.
Если x=0, то комплекс нейтрален.
Билет 19.
Комплексоны и их комплексы применяют при лечении различных металлоизбыточных и металлодефицитных состояний, связанных с заболеваниями, которые вызываются нарушениями обмена кальция, железа, меди и др. (рахит, психические заболевания, профилактика радиационных поражений).
Иногда длительное поступление в организм малых количеств ядовитых металлов приводит к их накоплению в различных внутренних органах и тканях, вследствие чего их концентрация в крови и моче существенно не повышена. Введение же комплексонов увеличивает выведение яда с мочой и тем самым указывает на его присутствие в организме. В таких случаях комплексоны можно использовать в целях диагностики. Иными словами, процесс комплексообразования приводит к нарушению установившегося равновесия между ионизированным металлом плазмы крови и металлом, содержащимся, например, в жировых тканях, а также в эритроцитах, печени, костной ткани и т.д.
Молекулы комплексонов практически не подвергаются расщеплению или какому-либо изменению в биологической среде, что является их важной фармакологической особенностью. Комплексоны нерастворимы в липидах и хорошо растворимы в воде, поэтому они не проникают или плохо проникают через клеточные мембраны, а следовательно, 1) не выводятся кишечником; 2) всасывание комплексообразователей происходит только при их инъекции (лишь пеницилламин принимают внутрь); 3) в организме комплексоны циркулируют по преимуществу во внеклеточном пространстве; 4) выведение из организма осуществляется главным образом через почки. Этот процесс происходит быстро. Так, уже через полтора часа после внутрибрюшинной инъекции в организме остается 15% введенной дозы тетацина, через 6 часов - 3%, а через двое суток - только 0,5%.Комплексоны малотоксичны, их токсическое действие проявляется в основном в повреждении слизистой оболочки тонкой кишки и почечных канальцев. При быстром вливании или введении больших количеств полиаминополикарбоновых кислот вследствие уменьшения содержания кальция в крови возможно нарушение возбудимости мышц и свертываемости крови.
Комплексные соединения- это, как правило, ярко окрашенные солеобразные вещества. Одним из первых были открыты разноцветные комплексные соли железа и кобальта. Весьма существенно, что многие биокатализаторы- ферменты также являются комплексными соединениями.
Комплексы в присутствии растворителя всегда в той или иной степени диссоциируют, т.е. разрушаются с образованием исходного иона металла и линганда. Очевидно, что ион металла будет находится не в свободном, а в сольватированном виде. В большинстве случаев в малополярных растворителях комплексные частицы диссоциируют в меньшей степени, чем в полярных, так как молекулы полярных растворителей ослабляют электрическое взаимодействие между ионом-комплексообразователем и лигандами. Если диссоциация комплекса протекает в воде, то в результате образуется аквакомплекс металла. Схематично процесс диссоциации комплексной части можно представить следующим образом:
[M(L)n]z-nx+mH2O = [M(H2Om)]z+ +nLx-
Прочность комплексных ионов и многих молекулярных комплексов сравнивают по отношению к воде, т. е. с прочностью аквакомплексов. Поэтому гидратированный ион металла условно считают «свободным», т. е. не связанным в комплексе, а уровнения диссоциации комплексов записывают без учета образования аквакомплексов, т. е. в следующем виде:
[M(L)n]z-nx = Mz+ + nLx-
Характеристикой прочности комплексных соединений является константа нестойкости:
a(Mz+)a(Lx-)
Kнест = --------------------------.
a([MLn]z-nx)
Чем меньше константа нестойкости комплексного соединения, тем оно прочнее; однако такая закономерность применима только к однотипным комплексам, т.е. имеющим одинаковое число лигандов во внутренней сфере. Комплексные частицы, имеющие в составе несколько лигандов, диссоциируют ступенчато, подобно многоосновным кислотам. Например:
[Ag(NH3)2]+ = [Ag(NH3)]+ + NH3
[Ag(NH3)]+ = Ag+ + NH3
Каждая из ступеней может быть охарактеризована константой нестойкости:
a([Ag(NH3)]+)a(NH3)
Kнест,1 =-----------------------------------------;
a([Ag(NH3)2]+)
Как и в большинстве других случаев, для приближенных расчетов вместо активностей обычно используют концентрации.
Общая константа нестойкости комплекса равна произведению констант нестойкости по степеням, как следует из термодинамики.
Для данного случая справедливо:
Kнест,1-2 = Кнест,1Кнест,2.
Металлоферменты, или металлоэнзимы — общее собирательное название класса ферментов, для функционирования которых необходимо присутствие катионов тех или иных металлов. В подобном ферменте могут присутствовать несколько различных ионов металла. Катион металла при этом обеспечивает правильную пространственную конфигурацию активного центра металлофермента.
Примерами металлоферментов являются селен-зависимая монодейодиназа, конвертирующая тироксин в трийодтиронин, или железо-зависимые тканевые дыхательные ферменты.
Помимо принадлежности к классу ферментов, металлоферменты принадлежат также к обширному классу металлопротеидов — белков (не обязательно ферментов), в состав которых входят катионы металлов
. (принцип ЖМКО): кислотно-основные взаимодействия протекают таким образом, что "жесткие" кислоты предпочтительно связываются с "жесткими" основаниями, а "мягкие" кислоты - с "мягкими" основаниями. При оценке "жесткости" и "мягкости" кислот и оснований учитывают их хим. состав и электронное строение, а также сравнительную устойчивость образуемых ими кислотно-основных комплексов: А + :В D А : В, где А - кислота Льюиса, :В - основание, А : В - кислотно-основной комплекс. "Жесткие" кислоты - акцепторы с низкой поляризуемостью, высокой электроотрицательностью, трудно восстанавливаются, их незаполненные граничные орбитали имеют низкую энергию; "мягкие" кислоты - акцепторы с высокой поляризуемостью, низкой электроотрицательностью, легко восстанавливаются, их своб. граничные орбитали имеют высокую энергию. "Жесткие" основания - доноры с низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются, их занятые граничные орбитали имеют низкую энергию; "мягкие" основания доноры с высокой поляризуемостью, низкой электроотрицательностью, легко окисляются, их занятые граничные орбитали имеют высокую энергию. Самая "жесткая" кислота - протон, самая "мягкая" CH3Hg+; наиб. "жесткие" основания - F и ОН-, наиб. "мягкие" I- и Н-. Сопоставление устойчивости кислотно-основных комплексов для разл. оснований по отношению к Н+ и CH3Hg+ , a также для кислот по отношению к F- и I- позволило разделить известные кислоты и основания на группы. Предпочтительное связывание "жестко-жестких" и "мягко-мягких" реагентов в рамках теории возмущения объясняется тем, что взаимод. между орбиталями с близкой энергией более эффективно, чем между орбиталями, разнящимися по энергии, т. е. подчеркивается преимущество электростатич. ("жестко-жесткого") или ковалентного ("мягко-мягкого") взаимодействия. Принцип ЖМКО используют для учета специфич. взаимод. и особенностей протекания конкурирующих процессов, для направленного создания экстрагентов, детоксикантов, лек. препаратов, а также объяснения преимуществ. типов связывания металлов в биохим. и геол. объектах. Принцип сформулирован Р. Пирсоном в 1963
Билет20
Биогенные элементы-химические элементы, постоянно входящие в состав организмов и имеющие определённое биологическое значение. Прежде всего это кислород (составляющий 70% массы организмов), углерод (18%), водород (10%), кальций, азот, калий, фосфор, магний, сера, хлор, натрий, железо. Эти элементы входят в состав всех живых организмов, составляют их основную массу и играют большую роль в процессах жизнедеятельности.
Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.
Для 30 элементов биогенность установлена. Существует несколько классификаций биогенных элементов:
А) По их функциональной роли:
1) органогены, в организме их 97,4% (С, Н, О, N, Р, S),
2) элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме;
3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы).
Б) По концентрации элементов в организме биогенные элементы делят:
1) макроэлементы;
2) микроэлементы;
3) ультрамикроэлементы.
Ксенобиотики — условная категория для обозначения чужеродных для живых организмов химических веществ, естественно не входящих в биотический круговорот. Как правило, повышение концентрации ксенобиотиков в окружающей среде прямо или косвенно связано с хозяйственной деятельностью человека. К ним в ряде случаев относят: пестициды, некоторые моющие средства (детергенты), радионуклиды, синтетические красители, полиароматические углеводороды и др. Попадая в окружающую природную среду, они могут вызвать повышение частоты аллергических реакций, гибель организмов, изменить наследственные признаки, снизить иммунитет, нарушить обмен веществ, нарушить ход процессов в естественных экосистемах вплоть до уровня биосферы в целом.
Все живые организмы имеют тесный контакт с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствует питание и потребляемая вода. Организм состоит из воды на 60%, 34% приходится на органические вещества и 6% на неорганические. Основными компонентами органических веществ являются С, Н, О. В их состав входят также N, P, S. В составе неорганических веществ обязательно присутствуют 22 химических элемента (смотрите таблицу № 1). Например, если вес человека составляет 70 кг, то в нём содержится (в граммах): Са - 1700, К - 250, Na –70, Mg - 42, Fe - 5, Zn - 3. На долю металлов приходится 2,1 кг. Содержание в организме элементов IIIA–VIA групп, ковалентносвязанных с органической частью молекул, уменьшается с ростом заряда ядра атомов данной группы периодической системы Д. И. Менделеева. Например, w(О) > w(S) > w(Se) > w(Fe). Количество элементов, находящихся в организме в виде ионов (s-элементы IA, IIА групп, р-элементы VIIA группы), с ростом заряда ядра атома в группе увеличивается до элемента с оптимальным ионным радиусом, а затем уменьшается. Например, во IIА группе при переходе от Be к Са содержание в организме увеличивается, а затем от Ва к Ra снижается. Элементы, аналоги, имеющие близкое строение атомов, имеют много общего в биологическом действии. В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определенном уровне.
Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, ионы электролитного фона и железо. Они составляют 99,99% живого субстрата. Еще более поразительно, что 99% живых тканей содержат только шесть элементов: С, Н, О, N, Р, Ca. Элементы К, Na, Mg, Fe, Сl, S относят к олигобиогенным элементам. Содержание их колеблется от 0,1 до 1%. Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них £ 0,001% (10-3 – 10-5%).Большинство микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Некоторые микроэлементы проявляют сродство к определенным тканям ( йод - к щитовидной железе, фтор - к эмали зубов, цинк - к поджелудочной железе, молибден - к почкам и т.д.). Элементы, содержание которых меньше чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца. Некоторые из них постоянно содержатся в организме животных и человека: Ga, Ti, F, Al, As, Cr, Ni, Se, Ge, Sn и другие. Биологическая роль их мало выяснена. Их относят к условно биогенным элементам. Другие примесные элементы (Те, Sc, In, W, Re и другие) обнаружены в организме человека и животных, и данные об их количестве и биологической роли не выяснены. Примесные элементы также делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F).
Органогены — главные химические элементы, входящие в состав органических веществ: углерод, водород, кислород и азот. Органогеном номер 1,несомненно, является углерод. Он способен образовывать прочные ковалентные связи. Кислород и водород скорее следует рассматривать как носители окислительных и восстановительных свойств органических соединений углерода. Остальные три органогена-азот, фосфор и сера, а также некоторые другие элементы- железо, магний, составляющие активные центры ферментов, как и углерод, очень лабильны. Для органогенов характерно образование водорастворимых соединений, что способствует их концентрированию в живых организмах.
Химические элементы, наиболее необходимые в значительных содержаниях для нормального развития организмов, расположены или непосредственно на "линии жизни" или вблизи от нее. Сама линия жизни (ее еще называют "линией питательных веществ") представляет собой ломаную, соединяющую в таблице Д. И. Менделеева углерод с железом и калием.
О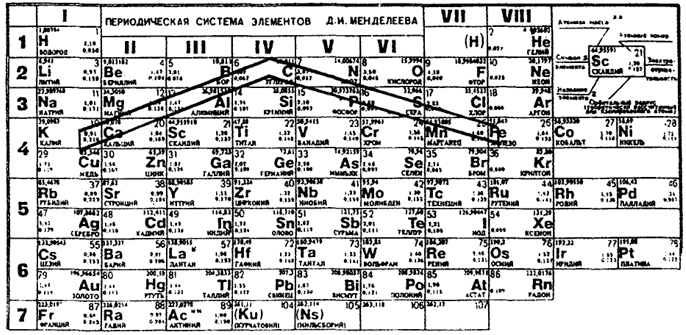 сновным
элементом в организмах, как и в земной
коре, является кислород. Основу живого
вещества составляют химические элементы,
доминирующий изотоп которых построен
по типу 4n (12C, 160, 24Mg, 28Si, 32S, 40Ca, 60Fe). При этом
легкие элементы преобладают над тяжелыми.
Закономерности, указанные для всей
массы живого вещества, справедливы и
для человеческого организма
сновным
элементом в организмах, как и в земной
коре, является кислород. Основу живого
вещества составляют химические элементы,
доминирующий изотоп которых построен
по типу 4n (12C, 160, 24Mg, 28Si, 32S, 40Ca, 60Fe). При этом
легкие элементы преобладают над тяжелыми.
Закономерности, указанные для всей
массы живого вещества, справедливы и
для человеческого организма
Форма нахождения химических элементов в среде обитания организмов. Состав живого вещества и условия развития жизни на Земле во многом определяются и преобладанием определенных форм нахождения химических элементов в среде обитания организмов. Так, в составе земной коры преобладают химические элементы, для которых предпочтительной является минеральная форма, а организмы поглощают в основном химические элементы, находящиеся в водных растворах, газовых смесях и в биологической форме. Это сказалось и на особенностях химического состава организмов:
воздушные мигранты составляют в живом веществе свыше 98% его массы, а в земной коре – лишь около 50%;
среди водных мигрантов (по А.И. Перельману) в организмах преобладают подвижные. На их долю приходится 0,7%, а на долю малоподвижных – около 0,5%. В земной же коре преобладают слабо- и малоподвижные, составляя свыше 44%. На долю подвижных приходится всего около 8%;
обособленные в пространстве земной коры такие формы нахождения элементов, как минеральная, водные растворы, газовые смеси, коллоидная и сорбированная, в живом веществе часто пространственно совмещены, образуя единый организм.
К ак
уже указывалось, с учетом форм нахождения
химических элементов в составе земной
коры при различных экологических
исследованиях отдельно выделяются
гидросфера, атмосфера, почвы и живое
вещество. Все они имеют огромное значение
и свою специфику воздействия на
безопасность жизнедеятельности людей.
ак
уже указывалось, с учетом форм нахождения
химических элементов в составе земной
коры при различных экологических
исследованиях отдельно выделяются
гидросфера, атмосфера, почвы и живое
вещество. Все они имеют огромное значение
и свою специфику воздействия на
безопасность жизнедеятельности людей.
Окружающую среду загрязняют многие отрасли промышленности и даже отходы домашнего хозяйства, а также химические предприятия. Воздух над ними насыщен мельчайшими твердыми частицами и ядовитыми газами.
Загрязнение атмосферного воздуха происходит также в результате газовых выбросов при получении оксидов металлов из сульфидных руд: 2ZnS+3O2=2ZnO+2SO2
Также пагубное действие кислотных дождей проявляется и в том, что они переводят в растворе металлы из твердых оксидов, в том числе и токсичные металлы: ZnO(т)+2H+=Zn2+(р)+Н2O
При работе двигателей внутреннего сгорания выделяются оксид азота и образуется озон:
N2+O2+2NO2(в цилиндре двигателя)
2NO+O2=2NO2
NO2+hv=NO+O
O+O2=O3
Которые загрязняют атмосферу.
