
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
H2O + H2O= H3O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+].
Т.е. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. (Моль — единица измерения количества вещества.)
Если в воде пониженное содержание свободных ионов водорода [H+] (рН > 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН < 7) - кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга и в нейтральной воде рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению значения рН.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
для сильной кислоты:
pH = -log[H+]
для слабой кислоты:
pH = ½ (рКа – lgСкисл)
или pH = ½ (-lgKкисл – lgСкисл)
для сильного основания:
pH = 14- pOH; (pOH=-lg[OH]; [OH]=Cоснования; C= m / MV)
или если дано Kb,тогда pOH= ½ (pKb - Cоснования) (pKb=-lgKb; pOH= ½ (-lgKb - Cоснования; pH=14-pOH)
для слабого основания :
pH = 14 - ½pKb + ½ lgC
15. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
NH3(осн.1) + H2O(кисл.2) = NH4+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза - необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + H2O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + H2O ↔ HNO2 + OH−
NH4+ + H2O = NH4ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
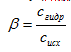 (7.37)
(7.37)
Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз
протекает в заметной степени только в
разбавленных растворах
![]() ,
тогда следовательно
,
тогда следовательно
![]() ,Это
произведение называется константой
гидролиза (Кг):
,Это
произведение называется константой
гидролиза (Кг):

Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
 где
Ккислота – константа диссоциации слабой
кислоты.
где
Ккислота – константа диссоциации слабой
кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:
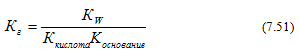
Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7H2O; Fe2(SO4)3.9H2O), алюминия Al2(SO4)3.18H2O), или хлорида железа (FeCl3.6H2O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
