
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
Закон действующих масс(Гультберг, Вааге):
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
V=kCaA*CbB
k – константа скорости хим р-ции (отвечает за природу химических веществ, агрегатное состояние)
С – молярная концентрация
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например для реакции:
 aA
+ bB
продукты
aA
+ bB
продукты
V=kc(A)в степени p * c(B) в степени q
Где p,q – найденные экспериментальным путем коэффициенты
k-константа скорости реакции, размерность которой зависит от значений p,q
C-концентрации реагентов А и В
a, b – стехиометрические коэффициенты
Константа скорости есть величина постоянная, не зависящая от концентрации реагентов.
При представлении концентрационной зависимости скорости в виде закона действующих масс предполагается, что скорость зависит от концентрации реагентов А и В. Физический смысл константы скорости реакции нетрудно установить – она численно равна скорости реакции, в которой концентрации реагирующих веществ равна 1 моль\ л или их произведения равно единице:
Если (А) = (В) = 1 моль\л = V = k *1 * 1 , т.е. V = k.
Это скорость данной реакции в стандартных условиях.
Порядок реакции - это число равное сумме показателей степеней концентраций реагирующих веществ в кинетическом уравнении реакции. Порядок реакций характеризует формально кинетическую зависимость скорости реакции от концентрации реагирующих веществ. Реальный порядок реакций устанавливается экспериментальным путем и часто не совпадает с теоретическим.
Реакции нулевого порядка:
-dc/dt =k откуда С0 – Сt =kt
По нулевому порядку проходят следующие процессы:
-фотохимические реакции, скорость которых определяется количеством поглощенного света.
- каталитические реакции, скорость которых зависит от концентрации только катализатора
-реакции, в которых убыль исходного вещества постоянно восполняется его поступлением из другой фазы.
Прямая идет параллельно оси абсцисс, tg( альфа )=0, т.е. p + q =0
V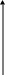


C
Реакции первого порядка: в том случае если угол наклона прямой на графике составляет 45 градусов, tg= 1
-

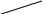 dc/dt=kc
dc/dt=kc
v
c
Реакции второго порядка:
-dc/dt=kt(в квадрате)
График кривая
Вопрос 6. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции; энергия активации; уравнение Аррениуса.
Зависимость скорости реакции от температуры.
Правило Вант-Гоффа: скорость большинства реакций увеличивается приблизительно в 2-4 раза при увеличении температуры на 100С: Vt2=Vt1*γt2-t1/10, где γ – температурный коэффициент константы скорости реакции(in vitro - в стекле, стакане, вне γ=(2-4), in vivo – внутри γ=(15-9))
Уравнение Аррениуса для константы скорости: k=Ae-Ea/RT, где Еа (энергия активации Дж/моль) и А – постоянные, не зависящие от температуры величины, R – универсальная газовая постоянная, Т – абсолютная температура.
Уравнение, которое часто используют для различных расчетов, получают путем неопределенного интегрирования : k=А*e(-E/RT), где k – константа (моль*л/сек), А – предэкспотенциальный множитель, где Еа - энергия активации (Дж/моль).
Теория активных соударений (Аррениус):
Реакционноспособными являются не все молекулы, а только те, которые находятся в особом активном состоянии.
Активные молекулы образуются из обычных в результате протекания обратимого процесса поглощения энергии.
Активные молекулы превращаются в молекулы конечного продукта со скоростью, не зависящей от температуры.
Влияние температуры на скорость химического процесса сводится к смещению равновесия между обычными и активными молекулами в сторону увеличения концентрации последних.
Энергия активации – это тот энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции.
