
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
Любая система в соответствии со вторым началом термодинамики стремится самопроизвольно перейти в такое состояние, при котором она обладает минимальным запасом энергии Гиббса. Следовательно, она стремится к минимуму поверхностной энергии Гиббса (Gs = S). Поэтому система, образованная одним компонентом, к примеру чистым растворителем ( = const при
Т = const), может понизить запас своей поверхностной энергии Гиббса в данных условиях только одним путем – принять форму, при которой поверхность раздела фаз минимальна.
Система, состоящая больше чем из одного компонента, помимо уменьшения площади поверхности, может понизить поверхностную энергию Гиббса и путем уменьшения поверхностного натяжения (), то есть путем перераспределения растворенного вещества между объемом жидкой фазы и поверхностным слоем. Рассмотрим возможные случаи распределения растворенного вещества в водном растворе (рис.4).
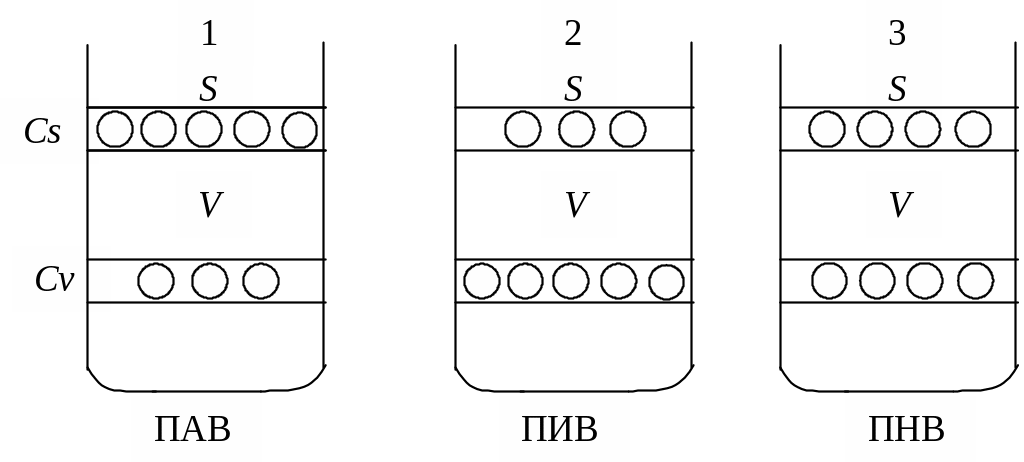
Рис.4 . Возможные случаи распределения растворенного вещества между
поверхностным слоем и объемом жидкой фазы (воды).
Сs – концентрация растворенного вещества в поверхностном слое;
Сv – концентрация растворенного вещества в объеме фазы
1. ПАВ уменьшают поверхностное натяжение растворителя (воды) и поэтому накапливаются в поверхностном слое (Сs>Сv), в связи с чем в системе уменьшается запас поверхностной энергии Гиббса. ПАВ должны обладать: а) поверхностным натяжением меньшим по сравнению с поверхностным натяжением растворителя, иначе накопление вещества в поверхностном слое было бы термодинамически невыгодно; б) сравнительно малой растворимостью (если бы они были хорошо растворимы, то стремились бы уйти с поверхности вглубь жидкости).
2. ПИВ увеличивают поверхностное натяжение растворителя (воды), поэтому накапливаются в объеме фазы (Сs<Сv), поскольку только в этом случае запас поверхностной энергии Гиббса в системе относительно уменьшается. ПИВ должны обладать следующими свойствами: а) их поверхностное натяжение должно быть больше поверхностного натяжения растворителя; иначе они будут стремиться самопроизвольно накапливаться в поверхностном слое; б) их растворимость должна быть высокой, так как лишь при этом условии они будут стремиться уйти с поверхности в объем.
3. ПНВ не изменяют поверхностное натяжение растворителя (воды), поэтому их концентрация в поверхностном слое такая же, как и в объеме фазы (Сs=Сv).
Ориентация молекул ПАВ в поверхностном слое.
Структура биологических мембран

При малых концентрациях ПАВ углеводородные радикалы «лежат» на поверхности полярной жидкости, а полярные группировки погружены в нее (рис.8 а).
С увеличением концентрации ПАВ в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит в пределе к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя (рис.8 б), в котором молекулы ПАВ предельно ориентированы. Данный слой образно называется молекулярным частоколом Лэнгмюра. Существованием мономолекулярного насыщенного слоя объясняется постоянство предельной адсорбции Г у органических веществ одного и того же гомологического ряда.
Представления об ориентации молекул ПАВ в насыщенном адсорбционном слое сыграли большую роль в развитии учения о структуре биологических мембран
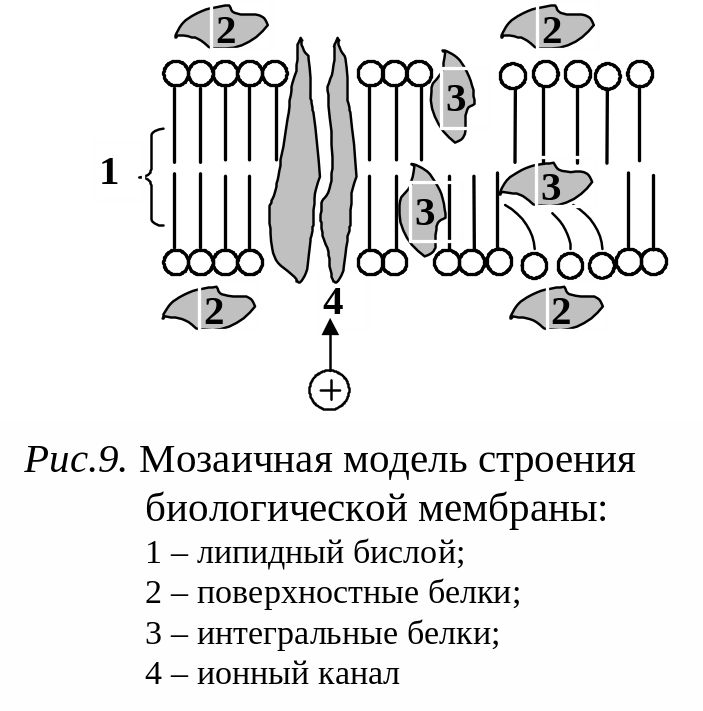
Клеточные мембраны образованы главным образом молекулами двух типов: липидами и белками.
Липиды
нерастворимы в воде, но растворимы в
органических растворителях. Особенностью
мембранных липидов является то, что на
одном конце их молекулы есть полярные
группы (например, –СООН),
обладающие гидрофильными свойствами,
тогда как другой ее конец представляет
собой длинную углеводородную цепь с
гидрофобными свойствами. Липиды образуют
бимолекулярные пленки (толщиной около
70![]() ),
в которых полярные группы располагаются
на обеих поверхностях мембраны, а
неполярные погружены внутрь ее.
),
в которых полярные группы располагаются
на обеих поверхностях мембраны, а
неполярные погружены внутрь ее.
Молекулы белка могут располагаться вблизи внешней и внутренней поверхностей мембраны, а также проникать, частично или полностью, через всю ее толщину.
Обычно клеточные мембраны весьма прочны и обладают свойствами электрического изолятора. Биологические мембраны не являются жесткими структурами. Например, во многих случаях белки и липиды внутри мембран находятся в постоянном движении.
Дополнение к вопросу:
Значение поверхностных явлений в медицине. Вода – наиболее часто применяющийся растворитель. Она обладает большим поверхностным натяжением (72,75 мДж / м при 20 С ), поэтому по отношению к ней многие вещества являются поверхностно-активными. Поверхностное натяжение биологических жидкостей (например, сыворотки крови – см. табл.1) меньше воды вследствие наличия в них ПАВ различной природы (кислоты жирного ряда, стероиды и др.). В результате эти вещества самопроизвольно накапливаются (адсорбируются) у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны.
Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. К примеру, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак и др.). С возрастом человека поверхностное натяжение сыворотки крови уменьшается.
Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют сталагмометрический метод (описан в экспериментальной работе.)
Вопрос №25. Классификация дисперсным систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния. Молекулярно-кинетические свойства коллоидно- дисперсных систем.
Дисперсные системы - системы, состоящие из дисперсной фазы – совокупности раздробленных частиц и непрерывной дисперсионной среды, в которой во взвешенном состоянии находятся эти частицы.
Классификация д.с. 1. По степени дисперсности:
Грубодисперсные (размер частиц от 10-7 до 10-5 м)
Коллоидно-дисперсные (размер частиц от 10-9 до 10-7 м)
2. По агрегатному состоянию фаз:
Коллоидно-дисперсные:
Системы с твердой дисперсионной средой – солидозоли
Системы с жидкой дисперсионной средой - лиозоли (золи)
Системы с газообразной дисперсионной средой – аэрозоли
Грубо-дисперсные:
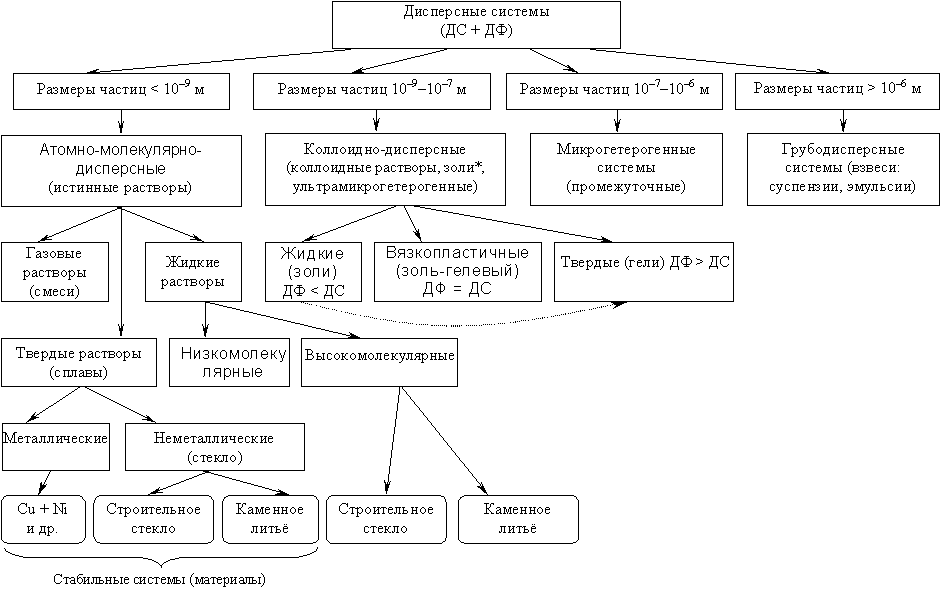
3. По интенсивности межмолекулярного взаимодействия:
Лиофобные – со слабым взаимодействием. Являются необратимыми: частицы дисперсионной фазы не способны самопроизвольно диспергироваться в дисперсионной среде. Характерны существенные отличия в химическом составе и строении граничащих фаз.(золи металлов, оксидов металлов, труднорастворимых солей в воде)
Лиофильные – с сильным взаимодействием. К ним относятся растворы высокомолекулярных веществ (мыло,алкалоиды,красители и т.д.)
Природа коллоидного состояния. Свойства коллоидно-дисперсных систем.
1. Все коллоидные растворы способны рассеивать свет или опалесцировать.
2. Диффузия частиц в коллоидных растворах протекает весьма медленно.
3. Коллоидные растворы имеют очень малое осмотическое давление, которое часто даже трудно обнаружить.
4. Коллоидные растворы способны к диализу, т. е. с помощью полупроницаемой перегородки (мембраны) могут быть отделены от растворенных в них примесей низкомолекулярных веществ. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а коллоидные частицы, неспособные проникать через полупроницаемую перегородку остаются за ней в виде очищенного коллоидного раствора.
5. Коллоидные растворы агрегативно неустойчивы (лабильны) - т. е. коллоиднорастворенное вещество способно сравнительно легко выделяться из раствора (коагулировать) под влиянием незначительных внешних воздействий. В результате в коллоидном растворе образуется осадок (коагулят, коагулюм)
6. Коллоидные растворы обычно обнаруживают явление электрофореза
Вопрос №26. Оптические свойства – рассеивание света. Электрические свойства: электрофорез и электроосмос. Строение двойного электрического слоя.
Оптические свойства коллоидных растворов. Прохождение света через коллоидную систему вызывает три оптических эффекта: поглощение, отражение и рассеивание лучей. Поглощение свойственно всем системам, тогда как отражение более характерно для грубодисперсних систем (эмульсий и суспензий), где размер частиц больше, чем длина волны облучения. Поэтому, в отличие от молекулярных и ионных растворов, которые не имеют поверхности раздела фаз и оптически однородны, коллоидные растворы рассеивают свет. Это проявляется опалесценцией в виде голубоватого матового свечения при освещении боковым светом. При пропускании параллельного пучка света через коллоидный раствор наблюдается конус рассеянного света – эффект Тиндаля. По способности рассеивать свет можно определять концентрацию коллоидных частиц в растворе - метод нефелометрии.
Электрокинетические свойства коллоидных растворов.
Электроосмос – явление перемещения дисперсной среды (т.е. растворителя) относи-тельно неподвижной дисперсной фазы, которое можно наблюдать при прохождении электрического тока через U–образную стеклянную трубку, заполненную кварцевым песком и водой. В катодной части трубки наблюдается повышение уровня воды. Электрофорез – явление перемещения коллоидных частиц относительно дисперснойсреды (растворителя), под влиянием постоянного электрического тока. Так, при прохождении электрического тока через устройство из двух стеклянных трубок, установленных в увлажненную глину, от поверхности отрываются отрицательно заряженные частицы глины,которые перемещаются к аноду. Метод электрофореза широко применяется в меди-цине для разделения Больших молекул и даже клеток. Существует много вариантов: свободный электрофорез, электрофорез на бумаге, в агаровом и полиакриламидном гелях и др.
Строение коллоидных частиц.
Считают, что коллоидный раствор состоит из мицелл, которые образуются заряженными коллоидными частицами. Заряд возникает вследствие избирательной адсорбции ионов на поверхности частиц, или за счет ионизации поверхностных функциональных групп твердой фазы. В мицелле различают три составных части: ядро, адсорбционный слой ионов и диффузионный слой ионов. Ядро составляет основную массу мицеллы и является совокупностью нейтральных атомов или молекул, общим числом сотни и миллионы единиц. На ядре адсорбируются ионы (избирательная адсорбция) которые придают ему определенный заряд,поэтому их называют потенциалообразующими. Потенциал, возникающий на ядре, получилеще название электротермодинамического и он обуславливает дальнейшее присоединение кпотенциал-образующим ионам некоторого количества других ионов с противоположнымзнаком заряда. Такой двойной электрический слой, потенциало-образующих ионов, вместе с противоионами (ионами з противоположным знаком) составляет адсорбционный слой ионов. Часть противоионов слабо связана с потенциало-образующими ионами и свободно перемещается в растворителе, формируя диффузионный слой. Ядро вместе с адсорбционным и диф-фузионным слоями ионов и составляет мицеллу, которая в целом является электронейтраль-ной (тогда как сама коллоидная частица несет определенный заряд).
29. Электрокинетический потенциал и его зависимость от различных факторов. Устойчивость дисперсных систем. Устойчивость коллоидных систем. Коагуляция. Порог коагуляции и его определение. Коллоидная защита и пептизация. Коагуляция в биологических системах.
Явление, обратное осмосу, называется потенциал протекания (возникновение разности потенциалов при продавливании жидкости через пористую перегородку)
При оседании частиц в жидкости возникает разность потенциалов между разными по высоте слоями жидкости – потенциал седиментации.
Перемещение дисперсной фазы или среды под действием внешнего электрического поля или возникновение разности потенциалов при перемещении дисперсной фазы и среды относительно друг друга называют электрокинетическими явлениями. Их причина – образование двойного слоя на границе раздела дисперсной фазы и среды и как следствие – наличие заряда. Электрический заряд на границе раздела фаз может возникать или в результате избирательной адсорбции на поверхности одного из ионов растворенного электролита, или вследствие диссоциации поверхностных молекул вещества дисперсной фазы. В результате этого возникает двойной электрический слой (ДЭС).
ДЭС состоит изпрочно связанных потенциалопределяющих ионов и эквивалентного числа противоположно заряженных ионов – противоионов. Расположение противоионов определяется тепловым движением (стремиться равномерно распределить ионы по всему объему жидкой фазы), силой электростатического притяжения (стремиться удержать их вблизи поверхности раздела фаз). В результате устанавливается диффузное распределение противоионов. Потенциалопределяющие ионы создают на поверхности дисперсной фазы электрический заряд. Противоположный по знаку заряд сосредоточен в дисперсной среде. Разность потенциалов между фазой и средой – электротермодинамический потенциал (определяется свойствами данной дисперсной системы)
Поверхность, по которой происходит перемещение фазы и среды, называется поверхностью скольжения. Скачок потенциала на поверхности скольжения тесно связан с электрокинетическими явлениями и называется электрокинетическим потенциалом. Электрокинетический потенциал – часть электродинамического. Его значение определяется толщиной диффузного слоя.
Электрокинетический потенциал зависит от температуры. С повышением температуры толщина слоя возрастает, но адсорбция уменьшается, что приводит к уменьшению электродинамического потенциала, а, значит, и электрокинетического.
Дисперсные системы являются термодинамически неустойчивыми. Под устойчивостью понимается ее способность сохранять во времени все параметры без обмена энергией и веществом с окружающей средой. Для коллоидно-дисперсных систем характерна термодинамическая неравновесность из-за наличия избытка свободной поверхностной энергии, связанного с сильно развитой поверхностью раздела фаз и большим значением межфазного натяжения на поверхности раздела фаз. Устойчивость дисперсных систем зависит от состава фазы и среды, от степени дисперсности и концентрации дисперсной фазы.
Различают седиментационную и агрегативную устойчивость.
Седиментационная – устойчивость частиц к оседания под действием силы тяжести. Условие – малый размер частиц дисперсной фазы, такой, чтобы сила тяжести не превышало энергию теплового движения и возрастания энтропии системы из-за броуновского движения. Основной фактор – энтропийный. Седиментационно неустойчивые системы расслаиваются.
Агрегативная устойчивость – способность дисперсных систем сохранять размер частиц и их индивидуальность. Фактор – энтропийный, т.к. тепловое движение делает невыгодным укрупнение частиц. В агрегативно неустойчивых системах происходит укрупнение частиц (коллоидно-дисперсные системы).
Коагуляция – потеря коллоидными системами агрегативной устойчивости.
Процесс коагуляции зависит от: формы частиц, полидисперсности, концентрации частиц дисперсной фазы, температуры, концентрации электролита-коагулята.
Коагуляция может быть вызвана: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
Минимальная концентрация электролита, по достижению которой начинается коагуляция, называется порогом коагуляции cпор. Величина, обратная порогу коагуляции, называется коагулирующей способностью КС=1/спор
Процесс коагуляции можно разделить на 2 стадии: скрытую и явную. Скрытая коагуляция – стадия агрегации, при которой не наблюдается внешних изменений. (изменение осматического давления, скорости диффузии, интенсивности броуновского движения, светорассеивания, скорости электрофореза)
Явная – обнаруживается зрительно. (изменение цвета, помутнение, осадок)
Пептизация – процесс перехода свежеполученного при коагуляции осадка в золь под действием веществ, называемых пептизаторами. Механизм пептизации заключается в увеличении сил отталкивания частиц за счет расширения диффузного слоя и увеличения Электрокинетического потенциала, что приводит к дезагрегации. Химическая пептизация состоит в том, что при добавлении электролита он взаимодействует с частью осадка, в результате чего образуется пептизатор, который придает оставшимся частицам осадка заряд.
В основе свертывания крови с рассасывания тромбов лежат процессы коагуляции и пептизации.
