
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
Основные понятия термодинамики:
Термодинамическая система – это отдельное тело или группа тел фактически или мысленно отделенных от окружающей среды.
Интенсивные и экстенсивные свойства системы:
Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F.
Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, A, T, P.
Термодинамический процесс – переход системы из одного состояния в другое, сопровождающееся изменением параметров.
Внутренняя энергия(U) – сумма всех кинетических и потенциальных составляющих системы. (мах)
Известны 2 формы передачи энергии:
Упорядоченную форму передачи энергии называют работой;
Неупорядоченную форму передачи энергии называют теплотой.
Типы термодинамических систем:
Изолированная – это система, которая не обменивается с окружающей средой ни массой, ни энергией.
Закрытая – это система, которая не обменивается с определенной средой массой, но обменивается энергией (ампула с лекарством, термос).
Открытая – это система, которая обменивается массой и энергией с окружающей средой.
Типы термодинамических процессов:
Если Т=const, то ∆U=0 и ∆H=A – изотермический процесс. (внут.энергия не изменяется)
Если ∆H=0, ∆U=-А и -∆U=А – адиабатический процесс. (работа производится только за счет изменения внут.энергии системы)
Если А=0 (р∆V=0), то ∆H=∆U, Qv=∆U – изохорный процесс. (все тепло идет на изменение внутренней энергии, работы нет)
Если p=const - изобарный процесс.
Вопрос 2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования, стандартная энтальпия сгорания. Закон Гесса. Термохимические процессы. Применение первого начала термодинамики к биосистемам. Примеры экзэргонических и эндэргонических процессов, протекающих в организме.
Первое начало термодинамики: (По своему существу первое начало термодинамики представляет собой закон сохранения и превращения энергии)
Энергия не создается и не уничтожается, возможно лишь превращение из одного вида в другой.
Вечный двигатель первого рода невозможен, т.е невозможно создать такой двигатель, который совершил бы работу без затраты энергии.
Внутренняя энергия изолированной системы есть величина постоянная.
Уравнение: Q=∆U+W (Q=∆U+p∆V)
Энтальпия – это то количество тепловой энергии, которое выделяется или поглощается при протекании процесса в условиях постоянства t и p(изобара) или t и V(изохора).
∆Н0хр=![]() vj∆H0f(продуктов)
-
vi∆H0f(исх.вв)
vj∆H0f(продуктов)
-
vi∆H0f(исх.вв)
Стандартная энтальпия образования вещества (∆H0f) – изменение (уменьшение или увеличение) энтальпии, сопровождающее образование 1 моль вещества в стандартных условиях из простых веществ, взятых в устойчивых модификациях.
Стандартная энтальпия сгорания вещества (∆Н0с) равна уменьшению энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления: оксида углерода(IV), воды, азота, оксида серы(IV).
Закон Гесса:
Теплота химической реакции , протекающей при постоянном объеме (или постоянном давлении) определяется только природой исходных веществ и продуктов реакции и не зависит от числа и последовательности промежуточных стадий, при условии, что теплоты измерены при одинаковой t.
Следствия из закона Гесса:
1. энтальпия образования любого соединения из простых веществ равна энтальпии его разложения на эти же вещества, но в обратным знаком ∆Н0обр= -∆Н0разл
2. энтальпия химической реакции равна разности сумм энтальпии образования продуктов реакции и исходных веществ ∆Н0хр= vi∆H0f(продуктов) - vj∆H0f(исх.вв)
3. энтальпия химической реакции равна разности сумм энтальпии сгорания продуктов реакции и исходных веществ ∆Н0хр= vi∆H0с(продуктов) - vj∆H0с(исх.вв)
4. свободная энергия реакции равна разности сумм свободной энергии продуктов и исходных веществ ∆G0р= vi∆G0обр(продуктов) - vj∆G0(исх.вв)
5.энтропия реакции ∆S0р= viS0обр(продуктов) - vjS0(исх.вв)
Термохимические процессы – переход системы из одного состояния в другое, сопровождающееся изменением параметров.
Применение первого начала термодинамики к биосистемам.
В 19 столетии было доказано экспериментально, что первый закон термодинамики применим к процессам, которые происходят в биологических системах.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом. Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ). ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке.
Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре:
C6H12O6 + 6O2 = 6CO2 + 6H2O
Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы.
Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3.
С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую.
Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов.
Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.
Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии.
Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии, который основан на вычислении энергетического выхода организма по использованию им кислорода.
Примеры экзэргонических и эндэргонических процессов, протекающих в организме.
Термические реакции, при протекании которых происходит уменьшение энергии Г(dG<0) и совершается работа называются ЭКЗЕРГОНИЧЕСКИМИ(окисление глюкозы дикислородом- C6H12O6+6O2=6CO2+6H2O, dG=-2880 кДж/моль! Реакции в результате которых энергия Г возрастает (dG>0) и над системой совершается работа, наз-ся ЭНДЕРГОНИЧЕСКИМИ!
Вопрос 3. Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия. Энергия Гиббса. Стандартная энергия Гиббса. Прогнозирование направления самопроизвольного процесса в изолированной и закрытой системах. Роль энтальпийного и энтропийного факторов.
Второй закон термодинамики:
Невозможен самопроизвольный переход от тела менее нагретого к более нагретому.
Невозможно превратить теплоту в работу не приводя никакого другого действия, кроме охлаждения источника тепла.
Вечный двигатель 2-го рода невозможен, т. е. такой двигатель, результатом которого было бы получение работы за счет тепла окружающей среды.
Все самопроизвольные процессы в макроскопических сис-мах протекают в направлении от менее вероятного к более вероятному состоянию сис-мы.
Обратимые – такие термодинамические процессы, при которых возвращение системы в первоначальное состояние не требует затраты энергии извне и связанных с этим изменений в окружающей среде.
Необратимые – термодинамические процессы, при которых возвращение системы в исходное состояние возможно лишь при условии затрат внешней энергии, что влечет за собой определенные изменения в окружающей среде.
Энтропия(S) характеризует меру беспорядка в расположении и поведении частиц составляющих сис-му, а также меру стремления частиц занять как можно больший V. Чем больше беспорядка, тем выше энтропия.
∆S0=∑vj(ню) S0(прод) - ∑vj(ню) S0(исх.в-в)
Энергия Гиббса(G) - часть внутренней энергии системы которая может быть переведена в работу.
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
В самопроизвольной реакции:
∆G<0 (G2-G1<0) ∆G>0
∆S>0 (S2-S1>0) реакция пойдет → ∆S<0 реакция пойдет ←
Формула для I и II т/д:
∆Gт=∆H0хр - Т∆S
Энтальпийный и энтропийный факторы
Из приведенного выражения следует, что самопроизвольное течение реакции может контролироваться как энтальпийным (∆H), так и энтропийным фактором (T∆S).
Очевидно, что для реакций, характеризующихся ∆Hr < 0 и ∆Sr > О, энергия Гиббса должна обязательно убывать, т. е. ∆Gr < 0, и такие реакции могут протекать самопроизвольно при любых температурах, так как оба фактора способствуют протеканию процесса. Пример такой реакции — гидролиз белка.
Наоборот, при ∆Hr > 0 и ∆Sr < 0 самопроизвольное течение реакций всегда невозможно, так как энергия Гиббса должна обязательно возрастать. Оба фактора препятствуют протеканию реакции. Пример — фотосинтез, т. е. образование глюкозы и кислорода из углекислого газа и воды.
Несогласованное действие факторов наблюдается в двух случаях:
1) ∆Hr > 0 и ∆Sr > 0 — самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса возможно при соотношении |∆Sr |> |∆Hr |, т. е. при достаточно высоких температурах. Примером процессов этого типа является тепловая денатурация белков;
2) ∆Hr < О и ∆Sr < О — благоприятствующим фактором является энтальпийный, соотношение AGT < 0 наблюдается при |∆Hr | > |∆Sr |, т. е. при достаточно низких температурах. Пример процессов этого типа — гидратация белков.
Вопрос 4. Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции. Классификация реакций, применяющиеся в кинетике: реакции гомогенные, гетерогенные; реакции простые и сложные. Молекулярность реакции. Кинетические уравнения. Порядок реакции. Период полупревращения.
Кинетика: раздел физ химии, изучающий скорость и механизмы хим реакций. Скорость – это число актов химического взаимодействия в ед времени в единице объема или площади, определяют как изменение концентрации одного из реагирующих веществ в ед времени. Скорость химической реакции зависит от природы веществ, от концентрации, температуры, от присутствия катализаторов и ингибиторов, для вещества в твердом состоянии – от поверхности реагирующих веществ.
Последовательность и характер стадий хим реакций называют механизмом реакции. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных веществ. Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Сложная реакция протекает в несколько стадий (Например, разложение озона) Все биохимические реакции – сложные.
Различают гомогенные и гетерогенные реакции. В гомогенные реакциях все исходные вещества находятся в одной фазе (2N2O5 -> 4NO2 + О2). В гетерогенных реакциях исходные вещества находятся в разных фазах (С(т)+О2(г)=СО2)
Молекулярность – число молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения. Она может характеризоваться только целыми числами.
Кинетические уравнения.
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции:
аА + ЬВ → продукты
v = kc(A)рс(B)q,
где р, q — эмпирические, т. е. найденные экспериментальным путем коэффициенты, не обязательно совпадающие со стехиометрическими коэффициентами а и Ь, к — константа скорости реакции, размерность которой зависит от значений р, q. Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации.
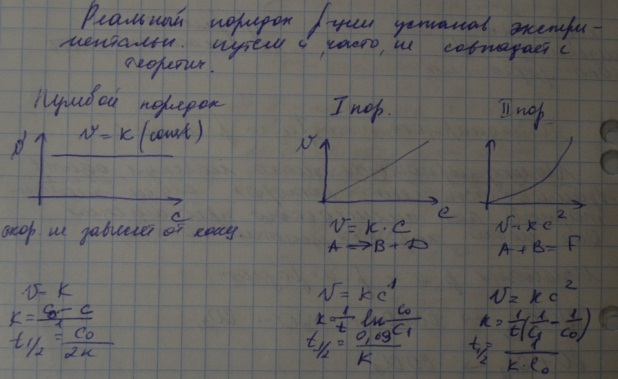
Порядок реакции – число, равное сумме показателей степеней концентраций реагирующих веществ в кинетическом уравнении реакции. Порядок реакции характеризует формально кинетическую зависимость скорости реакции от концентрации реагирующих веществ, а молекулярность – элементарный механизм отдельных стадий сложного процесса.
