
- •Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
- •Вопрос 5. Зависимость скорости реакции от концентрации реагентов. Кинетические уравнения реакций первого, второго и нулевого порядков.
- •Вопрос 7. Катализ. Гомогенный катализ, гетерогенный катализ. Особенности каталитической активности ферментов.
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Второй закон Рауля
- •Растворы электролитов
- •14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •16 Вопрос. Буферные системы:их классификация и механизм действия. Буферные системы крови бионеорганические и биоорганические. Буферная ёмкость. Кислотно-основный баланс организма
- •17. Лигандообразовательные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационные числа, дентантность.
- •18. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные нейтральные.
- •Вопрос №21. Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов 1а- и 2а-групп. Биологическая роль натрия, калия, магния, кальция.
- •Биологическая роль элементов. Химическое сходство и биологический антагонизм.
- •Вопрос №22.
- •Вопрос 23. Химия элементов p-блока
- •Адсорбция на подвижной границе раздела фаз (на поверхности жидкости)
- •Вопрос 30.
- •Вопрос 30 (следующий)
- •Вопрос 32. Потенциометрия.
- •Вопрос 33 Электродные потенциалы и механизмы их возникновения.
- •Вопрос 35. Жидкости и ткани организма как проводники второго рода. Удельная электропроводимость. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
П
![]() ервый
закон Рауля
связывает давление насыщенного пара
над раствором с его составом; он
формулируется следующим образом:
ервый
закон Рауля
связывает давление насыщенного пара
над раствором с его составом; он
формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Д
![]() ля
бинарного раствора, состоящего из
компонентов А и В (компонент А считаем
растворителем) удобнее использовать
другую формулировку:
ля
бинарного раствора, состоящего из
компонентов А и В (компонент А считаем
растворителем) удобнее использовать
другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Константа растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
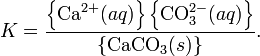
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1×10−4 моль/л необходимо использовать произведение активностей:
г
![]() де
аA и
аB —
активности ионов A и B.
де
аA и
аB —
активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
г
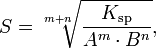 де:m+n —
суммарное количество молей катионов и
анионов
де:m+n —
суммарное количество молей катионов и
анионов
m —количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Образование осадка происходит, если:
Э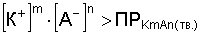 то
достигается прибавлением избытка
электролита, содержащего одноименный
ион K+ или
A-.
то
достигается прибавлением избытка
электролита, содержащего одноименный
ион K+ или
A-.
Например, если в раствор малорастворимого электролита СаСО3 внести хорошо растворимый сильный электролит Nа2СО3, то повысится концентрация иона СО32- и понизится концентрация иона Ca2+ и следовательно, снизится растворимость СаСО3, таким путем можно осаждать малорастворимые соединения.
Растворение осадка происходит, если:
Э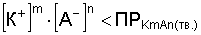 то
происходит, если связывается один из
ионов, посылаемых осадком в раствор.
то
происходит, если связывается один из
ионов, посылаемых осадком в раствор.
Например, растворение электролита FeS происходит при добавлении раствора соляной кислоты HCl. Ионы водорода связывают ионы S2- в молекулы H2S, которые удаляются в виде газа. Произведение концентрации ионов Fe2+ и S2- становится меньше произведения растворимости сульфида железа, и осадок растворяется.
Зная величину ПР, можно регулировать образование или растворение осадка, также оценить выпадает ли в данных условиях осадок. Для этого концентрацию ионов подставляют в выражение:
и![]() полученную величину сравнивают со
справочной. Осадок выпадет, если
полученная величина ПР превышает
табличную.
полученную величину сравнивают со
справочной. Осадок выпадет, если
полученная величина ПР превышает
табличную.
11.
Коллигативные свойства растворов- такие свойства растворов, которые зависят в основном от концентрации растворенных частиц и в значительно меньшей степени от их размера, молярной массы и других свойств. Проникновение воды через животную мембрану из конц. раствора, т.е. то, что мы называем осмосом, впервые описал Ноле. Блегден установил, что понижение температуры замерзания растворителя зависит от массы растворенного вещества. Оба явления-понижение температуры замерзания растворителя и осмос – следствия проявления общего закона, в соответствие с которым давление насыщенного пара растворителя над раствором нелетучего вещества меньше давления насыщенного пара над чистым растворителем при тойже температуре.
Закон Рауля: Первый закон Рауля
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, ПА;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва, где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
