
- •3.Криволинейное движение.
- •6. Внешние и внутренние силы.
- •7. Связь между импульсом тела и импульсом силы.
- •8. Центр масс. Закон движения центра масс.
- •9. Степени свободы твёрдого тела.
- •10. Момент силы, момент импульса.
- •11.Уравнение динамики тела, вращающегося относительно неподвижной оси
- •12. Момент инерции мат. Точки.
- •13. Теорема Штейнера.
- •14. Работа силы.
- •15. Потенциальная сила и её работа.
- •16. Работа внешних и внутренних сил.
- •17. Кинетическая энергия.
- •18. Потенциальная энергия.
- •19. Законы сохранения в механике и их связь со свойствами пространства и времени.
- •20. Абсолютно упругий удар.
- •21. Абсолютно неупругий удар.
- •22. Гидростатическое давление
- •23. Уравнение неразрывности
- •24. Уравнение Берноули
- •25. Вязкость жидкостей
- •26. Ламинарный и турбулентный режим течения жидкостей.
- •27. Скорость и ускорение мат.Точки при движении относительно неинерциальной системы отсчёта.
- •28. Основное уравнение динамики относительного движения. Силы инерции.
- •29.Преобразования Галилея. Принцип относительности Галилея.
- •30. Постулаты сто.
- •31.Преобразования Лоренца.
- •32. Однородность длин и промежутков времени.
- •33.Пространственно-временной интервал.
- •34. Основное уравнение релятивистской механики.
- •35.Масса и энергия в сто.
- •36. Статистический и термодинамический метод исследования макросистем.
- •37.Термодинамические системы.
- •38. Термодинамические процессы.
- •39. Термодинамические параметры.
- •40. Идеальный газ и его законы.
- •41. Основное уравнение кинетической теории газов.
- •42. Уравнение кинетической теории для давления идеального газа.
- •43. Средняя квадратичная скорость.
- •44. Закон равномерного распределения энергии по степеням свободы
- •45. Классическая теория теплоёмкости идеального газа.
- •46. Распределение Максвелла.
- •47. Барометрическая формула.
- •48. Зависимость концентрации газа от высоты.
- •49. Среднее число столкновений и средняя длина свободного пробега молекул.
- •50. Явление теплопроводности.
- •53.Вакуум и его свойства.
- •54. Способы обмена энергии между системой и внешней средой.
- •55. Первое начало термодинамики.
- •56.Применение первого начала к изопроцессам.
- •58. Политропный процесс.
- •59. Круговой процесс.
- •60. Цикл Карно
- •Смысл формулы Больцмана
43. Средняя квадратичная скорость.
Средняя квадратичная скорость поступательного движения молекул газа это корень из среднего арифметического значения квадратов скоростей молекул газа.
Средняя квадратичная скорость характеризует движение не одной частицы, а движение совокупности частиц. Молярная масса - масса 1 моль вещ-ва.
В одном моле любого вещества содержится одинаковое количество частиц равное постоянной Авогадро. NA
Средняя кинетическая энергия молекул.
<Wk> - средняя кинетическая энергия молекул.
Термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул.
44. Закон равномерного распределения энергии по степеням свободы
Закон равномерного распределения энергии по степеням свободы: на каждую степень свободы молекулы в среднем приходится одинаковое количество кинетической энергии равной
Кинетическая энергия молекулы имеющая i-степеней свободы
Однозначной функции состояния идеального газа является его внутренняя энергия, она равна кинетической энергии молекул газа.
Внутренняя энергия одного моля идеального газа
В общем случае внутренняя энергия идеального газа
45. Классическая теория теплоёмкости идеального газа.
Классический статистический метод изучения тепловых свойств вещества позволил теоретически вычислить теплоёмкость газов и других тел.
В общем случае теплоёмкость
в изотермическом процессе не изменяется
Поэтому считается что в данном процессе изменение температуры = 0.
В адиабатном процессе система не получает и не отдаёт теплоту. Теплоёмкость = 0.
При изохорном процессе (v=const) молярная теплоёмкость при постоянном объёме.
- Закон Майера
С помощью данных процессов можно найти как общую теплоёмкость (для этого молярную теплоёмкость надо умножить на кол-во вещества m/M) и удельную теплоёмкость (молярную теплоёмкость разделить на молярную массу)
Классическая теория теплоёмкости газов приводит к расхождению с опытными данными.
1. Теплоёмкость от температуры не зависит. Это не ТАК! Опыт показывает что для всех веществ теплоёмкость растёт с увеличением температуры.
2. Занижена оценка теплоёмкости. Причина всех трудностей в ограниченной пригодности закона равномерного распределения энергии по степеням свободы. В квантовой теории теплоёмкости эти трудности преодолены.
46. Распределение Максвелла.
Молекулы газа вследствие теплового движения испытывают многочисленные соударения друг с другом. При каждом соударении скорости молекул изменяются как по величине, так и по направлению. В результате в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям, зависящее от абсолютной температуры Т. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а величины скоростей подчиняются определенной закономерности. Распределение молекул газа по величине скоростей называется распределением Максвелла.
Если
одновременно измерить скорости большого
числа N молекул газа и выделить некоторый
малый интервал скоростей от v до v+![]() v,
то в выделенный интервал
v
попадает некоторое число
N
молекул. На графике удобно изображать
зависимость величины
v,
то в выделенный интервал
v
попадает некоторое число
N
молекул. На графике удобно изображать
зависимость величины 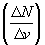 от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при
от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при ![]() (наиболее
вероятная скорость). Здесь m - масса
молекулы,
(наиболее
вероятная скорость). Здесь m - масса
молекулы, ![]() -
постоянная Больцмана.
-
постоянная Больцмана.
Характерным
параметром распределения Максвелла
является так называемая среднеквадратичная
скорость ![]() означает
среднее значение квадрата скорости. В
молекулярной физике доказывается, что
означает
среднее значение квадрата скорости. В
молекулярной физике доказывается, что
![]()
где ![]() -
молярная масса.
-
молярная масса.
Из выражения для среднеквадратичной скорости следует, что средняя кинетическая энергия поступательного движения молекул газа есть
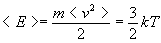
Распределение Максвелла является одной из важнейших статистических закономерностей молекулярной физики.
