
- •3.Криволинейное движение.
- •6. Внешние и внутренние силы.
- •7. Связь между импульсом тела и импульсом силы.
- •8. Центр масс. Закон движения центра масс.
- •9. Степени свободы твёрдого тела.
- •10. Момент силы, момент импульса.
- •11.Уравнение динамики тела, вращающегося относительно неподвижной оси
- •12. Момент инерции мат. Точки.
- •13. Теорема Штейнера.
- •14. Работа силы.
- •15. Потенциальная сила и её работа.
- •16. Работа внешних и внутренних сил.
- •17. Кинетическая энергия.
- •18. Потенциальная энергия.
- •19. Законы сохранения в механике и их связь со свойствами пространства и времени.
- •20. Абсолютно упругий удар.
- •21. Абсолютно неупругий удар.
- •22. Гидростатическое давление
- •23. Уравнение неразрывности
- •24. Уравнение Берноули
- •25. Вязкость жидкостей
- •26. Ламинарный и турбулентный режим течения жидкостей.
- •27. Скорость и ускорение мат.Точки при движении относительно неинерциальной системы отсчёта.
- •28. Основное уравнение динамики относительного движения. Силы инерции.
- •29.Преобразования Галилея. Принцип относительности Галилея.
- •30. Постулаты сто.
- •31.Преобразования Лоренца.
- •32. Однородность длин и промежутков времени.
- •33.Пространственно-временной интервал.
- •34. Основное уравнение релятивистской механики.
- •35.Масса и энергия в сто.
- •36. Статистический и термодинамический метод исследования макросистем.
- •37.Термодинамические системы.
- •38. Термодинамические процессы.
- •39. Термодинамические параметры.
- •40. Идеальный газ и его законы.
- •41. Основное уравнение кинетической теории газов.
- •42. Уравнение кинетической теории для давления идеального газа.
- •43. Средняя квадратичная скорость.
- •44. Закон равномерного распределения энергии по степеням свободы
- •45. Классическая теория теплоёмкости идеального газа.
- •46. Распределение Максвелла.
- •47. Барометрическая формула.
- •48. Зависимость концентрации газа от высоты.
- •49. Среднее число столкновений и средняя длина свободного пробега молекул.
- •50. Явление теплопроводности.
- •53.Вакуум и его свойства.
- •54. Способы обмена энергии между системой и внешней средой.
- •55. Первое начало термодинамики.
- •56.Применение первого начала к изопроцессам.
- •58. Политропный процесс.
- •59. Круговой процесс.
- •60. Цикл Карно
- •Смысл формулы Больцмана
54. Способы обмена энергии между системой и внешней средой.
Состояние системы может быть изменено 2 способами:
путём совершения работы, путём сообщения системе количества теплоты.
Количество теплоты - энергия передваиваемая путём теплообмена. [Q] Если тело получает теплоту, то Q>0, если отдаёт то Q<0.
Элементарное количество теплоты сообщаемое телу при изменении его температуры определяется формулой.
бQ = C*dT б- знак неполного дифференцирования который говорит что сообщаемое кол-во теплоты зависит от процесса.
С* - общая теплоёмкость тела
С* = m\M * C - молярная теплоёмкость
С* = m c - удельная теплоёмкость.
т.к. кол-во теплоты не является функцией состояния для каждого процесса, формула расчёта зависит от формулы расчёта теплоёмкости и ряда особенностей процесса.
Элементарная работа совершаемая при элементарном изменении объёма определяется выражением бA = pdV
Если система совершает работу над внешней средой, то A>0, если над системой то A<0
Работа не является функцией состояния системы, она зависит от вида процесса.
изобарный процесс бQ=m\M CpdT ; бA = pdv
изохорный процесс бQ=m\M CvdT ; бA = 0
изотермический процесс бQ= pdv ; бA = pdv
55. Первое начало термодинамики.
Кол-во теплоты бQ сообщённое системе равно сумме изменения её внутренней энергии dU и работе бA совершаемой системой над внешней средой.
бQ = dU + бА (1) или в интегральной форме полное кол-во теплоты полученной системой идёт на приращение внутренней энергии и на совершение работы Q = ΔU+A (2)
изобарный
![]()
изохорный
![]()
изотермический
![]()
56.Применение первого начала к изопроцессам.
Изопроцессы- Рановесные процессы, в котрых один из основных параметров сохраняется постоянным.
И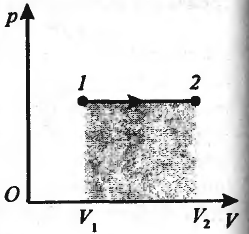 зобарный
процесс (p=const) Диаграмма
этого процесса (изобара) в координатах
p, V изображается прямой, параллельной
оси V. при изобарном процессе работа
газа при увеличении объема от V1
до V2
зобарный
процесс (p=const) Диаграмма
этого процесса (изобара) в координатах
p, V изображается прямой, параллельной
оси V. при изобарном процессе работа
газа при увеличении объема от V1
до V2
![]() и определяется площадью закрашенного
прямоугольника. Использую ур-е Клапейрона
pV=m/M RT получаем
и определяется площадью закрашенного
прямоугольника. Использую ур-е Клапейрона
pV=m/M RT получаем
![]() поэтому работа изобарного расширения
поэтому работа изобарного расширения
![]()
В
изобарном процессе при сообщении газу
массой m кол-ва теплоты
![]() его внутренняя возрастает на величину
его внутренняя возрастает на величину
![]()
И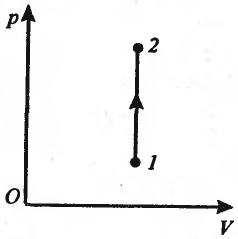
 зохорный
процесс (V=const)
Диаграмма
этого процесса (изохора) в координатах
p, V изображается прямой, параллельной
оси ординат. В изохорном процессе газ
над внешними телами работы не совершает:
(дельта)A=pdV=0.
Из первого начала термодинамики
зохорный
процесс (V=const)
Диаграмма
этого процесса (изохора) в координатах
p, V изображается прямой, параллельной
оси ординат. В изохорном процессе газ
над внешними телами работы не совершает:
(дельта)A=pdV=0.
Из первого начала термодинамики
![]() для изохорного процесса следует, что
вся теплота, сообщаемая газу, идет на
увеличение его внутренней энергии:
(дельта)Q=dU.
согласно
для изохорного процесса следует, что
вся теплота, сообщаемая газу, идет на
увеличение его внутренней энергии:
(дельта)Q=dU.
согласно
![]() ,
для произвольной массы газа
,
для произвольной массы газа
![]()
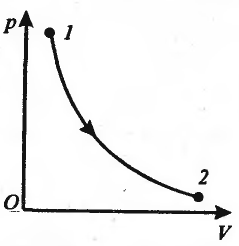
Изотермический
процесс (T=const)
Диаграмма
этого процесса (изотерма) в координатах
p,V изображается гиперболой (pV=const);
(дельта)A=pdV;
pV=m/M
RT.
Работа изотермического расширения
газа:
![]() Из первого начала термодинамики следует,
что в изотермическом процессе
(дельта)Q=(дельта)A,
т.е. все кол-во теплоты, сообщаемое газу,
расходуется на совершение им работы
против внешних сил:
Из первого начала термодинамики следует,
что в изотермическом процессе
(дельта)Q=(дельта)A,
т.е. все кол-во теплоты, сообщаемое газу,
расходуется на совершение им работы
против внешних сил:
![]() Чтобы при работе расширения температура
не уменьшалась, к газу в течение
изотермического процесса необходимо
подводить кол-во теплоты, эквивалентное
внешней работе расширения.
Чтобы при работе расширения температура
не уменьшалась, к газу в течение
изотермического процесса необходимо
подводить кол-во теплоты, эквивалентное
внешней работе расширения.
57.
Адиабатический процесс - процесс, при котором отсутствует теплообмен между системой и окружающей средой (ΔQ=0). Все быстропротекающие процессы можно отнести к адиабатическим. Уравнения состояний системы для адиабатического процесса:
PVλ=const - уравнение Пуассона, (61)
TVλ-1=const, TλPλ-1=const.
Диаграмма адиабатического процесса (адиабата) в координатах (p,V) изображается более крутой гиперболой, чем изотерма (рис. 15). Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. Первое начало термодинамики для адиабатического процесса (внешняя работа совершается за счет изменения внутренней энергии системы):
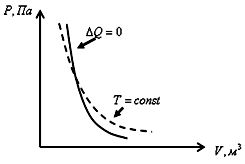 Рис.
15. Адиабатный процесс (адиабата)
Рис.
15. Адиабатный процесс (адиабата)
A=-ΔU, или PΔV=-mCvΔT/M. (62)
