
- •3.Криволинейное движение.
- •6. Внешние и внутренние силы.
- •7. Связь между импульсом тела и импульсом силы.
- •8. Центр масс. Закон движения центра масс.
- •9. Степени свободы твёрдого тела.
- •10. Момент силы, момент импульса.
- •11.Уравнение динамики тела, вращающегося относительно неподвижной оси
- •12. Момент инерции мат. Точки.
- •13. Теорема Штейнера.
- •14. Работа силы.
- •15. Потенциальная сила и её работа.
- •16. Работа внешних и внутренних сил.
- •17. Кинетическая энергия.
- •18. Потенциальная энергия.
- •19. Законы сохранения в механике и их связь со свойствами пространства и времени.
- •20. Абсолютно упругий удар.
- •21. Абсолютно неупругий удар.
- •22. Гидростатическое давление
- •23. Уравнение неразрывности
- •24. Уравнение Берноули
- •25. Вязкость жидкостей
- •26. Ламинарный и турбулентный режим течения жидкостей.
- •27. Скорость и ускорение мат.Точки при движении относительно неинерциальной системы отсчёта.
- •28. Основное уравнение динамики относительного движения. Силы инерции.
- •29.Преобразования Галилея. Принцип относительности Галилея.
- •30. Постулаты сто.
- •31.Преобразования Лоренца.
- •32. Однородность длин и промежутков времени.
- •33.Пространственно-временной интервал.
- •34. Основное уравнение релятивистской механики.
- •35.Масса и энергия в сто.
- •36. Статистический и термодинамический метод исследования макросистем.
- •37.Термодинамические системы.
- •38. Термодинамические процессы.
- •39. Термодинамические параметры.
- •40. Идеальный газ и его законы.
- •41. Основное уравнение кинетической теории газов.
- •42. Уравнение кинетической теории для давления идеального газа.
- •43. Средняя квадратичная скорость.
- •44. Закон равномерного распределения энергии по степеням свободы
- •45. Классическая теория теплоёмкости идеального газа.
- •46. Распределение Максвелла.
- •47. Барометрическая формула.
- •48. Зависимость концентрации газа от высоты.
- •49. Среднее число столкновений и средняя длина свободного пробега молекул.
- •50. Явление теплопроводности.
- •53.Вакуум и его свойства.
- •54. Способы обмена энергии между системой и внешней средой.
- •55. Первое начало термодинамики.
- •56.Применение первого начала к изопроцессам.
- •58. Политропный процесс.
- •59. Круговой процесс.
- •60. Цикл Карно
- •Смысл формулы Больцмана
58. Политропный процесс.
Политропный процесс - это термодинамический процесс при котором теплоёмкость остаётся постоянной.
Уравнение политропного процесса имеет вид
pV^n = const
n = C - Cp/C - Cv
Все изопроцессы являются частным случаем политропного процесса. Уточним значение показателя n и самый общий вид для уравнения процесса при изобарном, изохорном, изотермическим и адиабатном процессах.
Вид процесса |
n |
Уравнение процесса |
Изобарный |
0( С = Ср) |
P= const |
Изохорный |
∞ ( С = Сv) |
V= const |
Изотермический |
1( С = ∞) |
Pv = const, T = const |
Адиабатный |
n = γ |
|
59. Круговой процесс.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
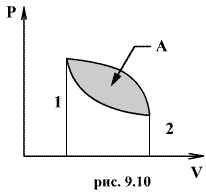
Круговым процессом (или циклом) называется такой процесс при котором система после ряда изменении возвращается в исходное состояние. На графике цикл изображается замкнутой кривой Работа совершаемая при круговом процессе, численно равна площади охватываемой кривой. После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
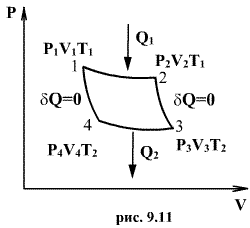
60. Цикл Карно
 Анализируя
работу тепловых двигателей, французский
инженер С. Карно в 1824г. пришел к выводу,
что наивыгоднейшим круговым процессом
является обратимый круговой процесс,
состоящий из двух изотермических и двух
адиабатических процессов, т.к. он
характеризуется наибольшим коэффициентом
полезного действия. Такой цикл получил
название цикла Карно. В прямом цикле
Карно рабочее тело изотермически, а
затем адиабатически расширяется, после
чего снова изотермически (при более
низкой температуре) и потом адиабатически
сжимается. Т.е. цикл Карно ограничен
двумя изотермами и двумя адиабатами.
Анализируя
работу тепловых двигателей, французский
инженер С. Карно в 1824г. пришел к выводу,
что наивыгоднейшим круговым процессом
является обратимый круговой процесс,
состоящий из двух изотермических и двух
адиабатических процессов, т.к. он
характеризуется наибольшим коэффициентом
полезного действия. Такой цикл получил
название цикла Карно. В прямом цикле
Карно рабочее тело изотермически, а
затем адиабатически расширяется, после
чего снова изотермически (при более
низкой температуре) и потом адиабатически
сжимается. Т.е. цикл Карно ограничен
двумя изотермами и двумя адиабатами.
При
изотермическом расширении от нагревателя
отбирается тепло ![]() (на
участке 1-2 рис. 9.11). Вследствие этого
температура газа поддерживается
неизменной. Соответственно, параметры
точки 2 будут равны
(на
участке 1-2 рис. 9.11). Вследствие этого
температура газа поддерживается
неизменной. Соответственно, параметры
точки 2 будут равны ![]() .
На участке 2-3 происходит адиабатное
расширение. Внутренняя энергия газа
уменьшается и его температура падает
до Т2.
Параметры точки 3 -
.
На участке 2-3 происходит адиабатное
расширение. Внутренняя энергия газа
уменьшается и его температура падает
до Т2.
Параметры точки 3 - ![]() .
На участке 3-4 газ изотермически сжимается.
Параметры точки 4 -
.
На участке 3-4 газ изотермически сжимается.
Параметры точки 4 - ![]() .
Выделяющееся при этом тепло
.
Выделяющееся при этом тепло ![]() отбирается
холодильником. Участок 4-1 -адиабатическое
сжатие до исходного состояния,
соответствующего точке 1. Таким образом,
завершен цикл “1-2-3-4-1 и в итоге нагреватель
отдал газу теплоту
,
а холодильник отобрал
Разность
отбирается
холодильником. Участок 4-1 -адиабатическое
сжатие до исходного состояния,
соответствующего точке 1. Таким образом,
завершен цикл “1-2-3-4-1 и в итоге нагреватель
отдал газу теплоту
,
а холодильник отобрал
Разность ![]() определяет
полезную работу газа за один цикл, так
как согласно I началу термодинамики
определяет
полезную работу газа за один цикл, так
как согласно I началу термодинамики ![]() ,
но для кругового процесса
,
но для кругового процесса ![]() и,
следовательно
и,
следовательно ![]() .
.
Отношение полезной работы к затраченной энергии нагревателя определяет коэффициент полезного действия (к.п.д.) тепловой машины:
|
(9.23) |
Эта формула справедлива для любого обратимого и необратимого процесса.
61.
Энтропия,
функция состояния S термодинамической
системы, изменение которой dS для
бесконечно малого обратимого изменения
состояния системы равно отношению
количества теплоты ![]() полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре Т.
полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре Т.
Из теоремы Клаузиуса следует, что приведенная теплота подобно энергии (потенциальной, внутренней) является функцией состояния (не зависит от пути перехода и зависит только от состояния системы). Независимость интеграла
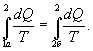
от пути перехода означает, что этот интеграл выражает собой изменение некоторой функции состояния системы, она называется энтропия и обозначается буквой S. Изменение энтропии системы, очевидно, равно
|
(9.30) |
Мы говорим
только об изменении энтропии (подобно
изменению потенциальной энергии ![]() ,
для которой не важно где начало отсчета).
Из уравнения (9.30) вытекает основное
количественное выражение второго начала
термодинамики
,
для которой не важно где начало отсчета).
Из уравнения (9.30) вытекает основное
количественное выражение второго начала
термодинамики
|
(9.31) |
Свойства энтропии.
1. Обратимый процесс. В случае обратимого процесса
![]()
Интеграл по замкнутому контуру - это изменение энтропии во всем цикле, т.е. при обратимых циклах энтропия не меняется:
![]() 2.
Необратимый процесс.
2.
Необратимый процесс.
Исходя из определения энтропии можем записать,
 С
другой стороны для необратимого
процесса
С
другой стороны для необратимого
процесса
![]() Следовательно
Следовательно
![]() или
с учетом обратимого процесса
или
с учетом обратимого процесса
|
(9.32) |
Таким образом, энтропия изолированной системы может только возрастать (если в системе протекают необратимые процессы), либо остается постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может.
физический смысл энтропии.
Пусть
имеем 2 тепловые обратимые машины с
общим холодильником, но с различными
нагревателями. Температура
холодильника
меньше
температуры нагревателей ![]() и
и ![]() ,
кроме того
,
кроме того ![]() Сравним
коэффициенты полезного действия машин
Сравним
коэффициенты полезного действия машин
![]() и
и ![]()
Т.к.
,
то ![]() ,
т.е. чем больше температура нагревателя
машины при общем холодильнике, тем выше
КПД.
,
т.е. чем больше температура нагревателя
машины при общем холодильнике, тем выше
КПД.
Рассмотрим
как изменяется значение энтропии
рабочего тела за один цикл. Пусть
температуры первой машины ![]() и
второй
и
второй ![]() больше
температуры холодильника, и пусть за
каждый цикл подводится одинаковое
количество теплоты. Рассмотрим для
какой машины будет больше изменение
энтропии
больше
температуры холодильника, и пусть за
каждый цикл подводится одинаковое
количество теплоты. Рассмотрим для
какой машины будет больше изменение
энтропии
![]()
где ![]() -
энтропия начального состояния,
-
энтропия начального состояния, ![]() -
энтропия конечного состояния; Т -
температура, при которой происходит
теплообмен. Энтропия нагревателя убывает
на величину
-
энтропия конечного состояния; Т -
температура, при которой происходит
теплообмен. Энтропия нагревателя убывает
на величину
![]()
а энтропия холодильника возрастает на величину
![]()
Так
как Q и
для
обеих машин одинаковы, то ![]() тоже
одинаковы.
тоже
одинаковы.
Изменение энтропии нагревателей (вследствие различия их температур различны
![]()
Таким, образом, изменение энтропии первой машины меньше, чем второй.
![]()
Следовательно, большему изменению энтропии рабочего тела за цикл соответствует меньший коэффициент полезного действия машины. Так как изменение энтропии холодильника одинаковое, то начальное значение энтропии больше для рабочего тела второй машины.
При этом, заведомо можно сказать, что КПД второй машины меньше. Таким образом, чем больше энтропия, тем меньше коэффициент полезного действия.
62.
Изоэнтропийный процесс — тепловой процесс, происходящий при постоянной энтропии.
Условия,
при которых тепловой процесс будет
изоэнтропийным, можно получить
из равенства
Клаузиуса для обратимых
процессов: ![]() ,
,
где dS — приращение (дифференциал) энтропии, а δQ — бесконечно малое полученное количество теплоты. Отсюда следует, что из обратимых процессов изоэнтропийным является только обратимый адиабатный процесс.
Из неравенства
Клаузиуса для необратимых
процессов ![]() ,
,
следует, что необратимый адиабатный процесс не может быть изоэнтропийным.
Но вообще и при необратимом процессе энтропия системы может сохранять постоянное значение, если вся производимая энтропия сразу удаляется с помощью теплообмена.
Линию на любой термодинамической диаграмме, изображающую изоэнтропийный процесс, можно называть изоэнтропой. Но обычно её называют адиабатой, так как необратимый процесс (в том числе необратимый адиабатный) нельзя корректно изобразить линией на диаграмме.
Изоэнтропийные процессы важны на практике (например, адиабатное размагничивание) и в теории (например, они входят в цикл Карно).
64.
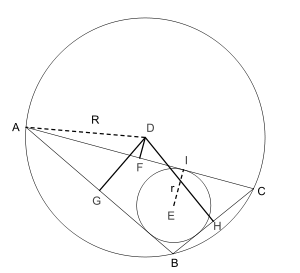
Первая теорема (более известна как формула Карно)
![]()
Первая теорема Карно: DG + DH + DF = | DG | + | DH | − | DF | = R + r
Пусть дан произвольный треугольник ABC. Тогда сумма алгебраических расстояний (англ.) от центра описанной окружности D до сторон треугольника ABC будет равна DF + DG + DH = R + r, где r — радиус вписанной окружности, а R — описанной. Знак расстояния принимается отрицательным тогда и только тогда, когда отрезок DX (X = F, G, H) целиком лежит вне треугольника. В ее доказательстве используетсятеорема Птолемея.
[править]Вторая теорема (известная также как критерий Карно)
Пусть дан треугольник АВС и точки А1, В1, С1 на плоскости. Тогда перпендикуляры, опущенные из А1, В1, С1 на ВС, АС, ВС соответственно, пересекаются в одной точке тогда и только тогда, когда A1B2 − A1C2 +B1C2 − B1A2 + C1A2 − C1B2 = 0.
[править]Следствие
Перпендикуляры, опущенные из А1, В1, С1 на AB, АС, ВС соответственно, пересекаются в одной точке тогда и только тогда, когда перпендикуляры, опущенные из А, В, С на В1С1, А1С1, В1С1 соответственно, пересекаются в одной точке.
65.
Выражая всеобщий закон сохранения и превращения энергии, первое начало термодинамики не позволяет определить направление протекания процесса. В самом деле, процесс самопроизвольной передачи энергии в форме теплоты от холодного тела к горячему ни в какой мере не противоречит первому закону термодинамики. Однако при опускании раскаленного куска железа в холодную воду никогда не наблюдается явление дальнейшего нагревания железа за счет соответствующего охлаждения воды. Далее, первое начало не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты, полученной от нагревателя в эквивалентную ей работу. Так, например основываясь на первом начале можно было бы попытаться построить периодически действующий двигатель, совершающий работу за счет одного источника тепла (например за счет внутренней энергии океана). Такой двигатель называется вечным двигателем второго рода. Обобщение огромного экспериментального материала привело к выводу о невозможности построения вечного двигателя второго рода. Этот вывод получил название второго начала термодинамики.
Существует ряд различных по форме, одинаковых по существу формулировок второго начала:
Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную ей работу.
Формулировка Клаузиуса: теплота сама собой не может переходить от менее нагретого тела к более нагретому.
Формулировка Томсона-Планка: перпетуум мобиле второго рода невозможен.
66.
S=k*ln(P), k = R/N = 1,38*10-23 Дж/К,(1)
где k - фундаментальная мировая постоянная Больцмана; R = 8,31 Дж/(моль*К) - молярная газовая постоянная; N = 6,06*1023 моль-1 - число Авогадро; Р - статистический вес: число способов осуществления данного состояния.
Параметр S - энтропия - служит мерой рассеяния энергии Вселенной, а Р - характеризует любые самопроизвольные изменения, эта величина относится к миру атомов, определяющих скрытый механизм изменения. Итак, формула (1), вывод которой дан отдельно, связывает энтропию с хаосом.
