
- •Ответы к экзамену по физике Вопрос №1. Скорость и ускорение при криволинейном движении. Кинематика вращательного движения.
- •2. Кинематика вращательного движения.
- •Вопрос № 4. Потенциальная и кинетическая энергия. Потенциальное силовое поле. Закон сохранения импульса.
- •Вопрос №5. Динамика вращательного движения: основные велечины, основное уравнение и закон сохранения момента импульса.
- •Вопрос №6. Пружинный маятник. Кинетическая, потенциальная и полная энергия колебательного движения.
- •Вопрос №7.
- •Вопрос №8. Основное уравнение молекулярно-кинетической теории газов. Термодинамическая температура.
- •Вопрос №9. Внутренняя энергия и теплота. Распределение энергии по степеням свободы молекул в идеальном газе.
- •Вопрос №10. Теплоёмкость термодинамической системы. 1-ое начало термодинамики.
- •Вопрос №18. Сила и плотность электрического тока. Условия существования электрического тока. Эдс и напряжение.
- •29. Закон полного тока. Вихревой характер магнитного поля
- •30. Движение заряженных частиц в магнитном поле
- •Вопрос 33
- •Вопрос 34 Колебательный контур. Электромагнитные колебания.
- •Постулаты
- •Опыт Франка — Герца
Постулаты

![]()
Модель атома Бора
Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам для которых момент импульса квантуется:
 ,
где n — натуральные
числа,
а
,
где n — натуральные
числа,
а  —постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.
—постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квантэнергии hν = En − Em, где En;Em — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается. Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
Опыт Франка — Герца
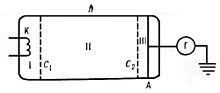
Схема электровакуумной трубки, использованной в эксперименте
 Зависимость
тока от напряжения. Видны острые
периодические пики, соответствующие
ионизации атомов.
Зависимость
тока от напряжения. Видны острые
периодические пики, соответствующие
ионизации атомов.
Опыт Франка — Герца — опыт, явившийся экспериментальным доказательством дискретностивнутренней энергии атома. Поставлен в 1913 Дж. Франком и Г. Герцем. На рисунке приведена схема опыта. К катоду К и сетке C1 электровакуумной трубки, наполненной парами Hg (ртути), прикладывается разность потенциалов V, ускоряющая электроны, и снимается зависимость силы тока I от V. К сетке C2 и аноду А прикладывается замедляющая разность потенциалов. Ускоренные в области I электроны испытывают соударения с атомами Hg в области II. Если энергия электронов после соударения достаточна для преодоления замедляющего потенциала в области III, то они попадут на анод. Следовательно, показания гальванометра Г зависят от потери электронами энергии при ударе. В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 В, то есть электроны с энергией Е < 4,9 эВ испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 В (и кратных ему значениях 9,8 В, 14,7 В) появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, то есть энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эв значениях энергии электроны могут испытывать неупругие столкновения несколько раз. Таким образом, опыт Франка — Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электро-магнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора
![]()
,где E0 и E1 — энергии основного и возбужденного уровней энергии. В опыте Франка — Герца, E0 — E1 = 4,9 эв. Артур Комптон, повторив (1922—1923) опыт Франка — Герца, обнаружил, что при V > 4,9 В пары Hg начинают испускать свет с частотой n = DE/h, где DE = 4,9 эВ (h — постоянная Планка). Таким образом, возбуждённые электронным ударом атомы Hg испускают фотон с энергией 4,9эВ и возвращаются в основное состояние. В 1925 г. Густав Герц и Джеймс Франк были награждены нобелевской премией за открытие законов соударения электрона с атомом.
Вопрос №49.
Линейчатые спектры атома водорода и их объяснение в рамках представлений Н. Бора.
Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории он был хорошо изучен экспериментально. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названасерией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
|
Для серии Бальмера m = 2, n = 3, 4, 5, ... . Для ультрафиолетовой серии (серия Лаймана)m = 1, n = 2, 3, 4, ... . Постоянная R в этой формуле называется постоянной Ридберга. Ее численное значение R = 3,29·1015 Гц. До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода (и ряда других атомов), оставались непонятными.
Постулаты Бора определили направление развития новой науки – квантовой физики атома. Но они не содержали рецепта определения параметров стационарных состояний (орбит) и соответствующих им значений энергии En.
Правило квантования, приводящее к согласующимся с опытом значениям энергий стационарных состояний атома водорода, Бором было угадано. Он предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде
|
Здесь me – масса электрона, υ – его скорость, rn – радиус стационарной круговой орбиты. Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением
|
где e – элементарный заряд, ε0 – электрическая постоянная. Скорость электрона υ и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
|
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен
|
Радиусы последующих орбит возрастают пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом rn, равна
|
Следует отметить, что Ep < 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ2 и rn, получим:
|
Целое число n = 1, 2, 3, ... называется в квантовой физике атома главным квантовым числом.
Согласно второму постулату Бора, при переходе электрона с одной стационарной орбиты с энергией En на другую стационарную орбиту с энергией Em < En атом испускает квант света, частота νnm которого равна ΔEnm / h:
|
Эта формула в точности совпадает с эмпирической формулой Ридберга для спектральных серий атома водорода, если положить постоянную R равной
|
Подстановка числовых значений me, e, ε0 и h в эту формулу дает результат
R = 3,29·1015 Гц, |
который очень хорошо согласуется с эмпирическим значением R. Рис. 6.3.1 иллюстрирует образование спектральных серий в излучении атома водорода при переходе электрона с высоких стационарных орбит на более низкие.
|
Рисунок 6.3.1. Стационарные орбиты атома водорода и образование спектральных серий |
На рис. 6.3.2. изображена диаграмма энергетических уровней атома водорода и указаны переходы, соответствующие различным спектральным сериям.
|
Рисунок 6.3.2. Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн |
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования. Это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах частиц.
Вопрос № 54.
Энергетические зоны в кристаллах. Проводники, диэлектрики и полупроводники. Энергия активации.
Согласно постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (также говорят, что электрон находится на одной из орбиталей).
В случае нескольких атомов, объединенных химической связью (например, в молекуле), электронные орбитали расщепляются в количестве, пропорциональном числу атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического кристалла (число атомов более 1020), количество орбиталей становится очень большим, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой, энергетические уровни расщепляются до практически непрерывных дискретных наборов — энергетических зон. Наивысшая из разрешённых энергетических зон в полупроводниках и диэлектриках, в которой при температуре 0 К все энергетические состояния заняты электронами, называется валентной зоной, следующая за ней — зоной проводимости. В металлах зоной проводимости называется наивысшая разрешённая зона, в которой находятся электроны при температуре 0 К.
Зонная структура различных материалов

Рисунок 1: Упрощенная зонная диаграмма для проводников, полупроводников и диэлектриков.
По взаимному расположению зон вещества делят на три большие группы (см. Рисунок 1):
проводники — зона проводимости и валентная зона перекрываются, образуя одну зону, называемую зоной проводимости, таким образом, электрон может свободно перемещаться между ними, получив любую допустимо малую энергию. Таким образом, при приложении к твердому телу разности потенциалов, электроны смогут свободно двигаться из точки с меньшим потенциалом в точку с большим, образуя электрический ток. К проводникам относят все металлы.
полупроводники — зоны не перекрываются и расстояние между ними составляет менее 3.5 эВ. Для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется энергия меньшая, чем для диэлектрика, поэтому чистые (собственные, нелегированные) полупроводники слабо пропускают ток.
диэлектрики — зоны не перекрываются и расстояние между ними составляет более 3.5 эВ. Таким образом, для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется значительная энергия, поэтому диэлектрики ток практически не проводят.
Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе.
Вопрос № 55.
Собственная проводимость в полупроводниках. Проводимость n- и p-типа.
Собственная проводимость - полупроводники, в которых свободные электроны и «дырки» появляются в процессе ионизации атомов, из которых построен весь кристалл, называют полупроводниками с собственной проводимостью. В полупроводниках с собственной проводимостью концентрация свободных электронов равняется концентрации «дырок».
Проводимость связана с подвижностью частиц следующим соотношением:
![]()
где ρ - удельное сопротивление, μn — подвижность электронов, μp — подвижность дырок, Nn,p — их концентрация, q — элементарный электрический заряд (1,602×10−19 Кл).
Для собственного полупроводника концентрации носителей совпадают и формула принимает вид:
![]()
Примесная проводимость - для создания полупроводниковых приборов часто используют кристаллы с примесной проводимостью. Такие кристаллы изготавливаются с помощью внесения примесей с атомами трехвалентного или пятивалентного химического элемента.
Электронные полупроводники (n-типа)
Термин «n-тип» происходит от слова «negative», обозначающего отрицательный заряд основных носителей. Этот вид полупроводников имеет примесную природу. В четырёхвалентный полупроводник (например, кремний) добавляют примесь пятивалентного полупроводника (например, мышьяка). В процессе взаимодействия каждый атом примеси вступает в ковалентную связь с атомами кремния. Однако для пятого электрона атома мышьяка нет места в насыщенных валентных связях, и он переходит на дальнюю электронную оболочку. Там для отрыва электрона от атома нужно меньшее количество энергии. Электрон отрывается и превращается в свободный. В данном случае перенос заряда осуществляется электроном, а не дыркой, то есть данный вид полупроводников проводит электрический ток подобно металлам. Примеси, которые добавляют в полупроводники, вследствие чего они превращаются в полупроводники n-типа, называются донорными.
Проводимость N-полупроводников приблизительно равна:
![]()
Дырочные полупроводники (р-типа)
Термин «p-тип» происходит от слова «positive», обозначающего положительный заряд основных носителей. Этот вид полупроводников, кроме примесной основы, характеризуется дырочной природой проводимости. В четырёхвалентный полупроводник (например, в кремний) добавляют небольшое количество атомов трехвалентного элемента (например, индия). Каждый атом примеси устанавливает ковалентную связь с тремя соседними атомами кремния. Для установки связи с четвёртым атомом кремния у атома индия нет валентного электрона, поэтому он захватывает валентный электрон из ковалентной связи между соседними атомами кремния и становится отрицательно заряженным ионом, вследствие чего образуется дырка. Примеси, которые добавляют в этом случае, называются акцепторными.
Проводимость p-полупроводников приблизительно равна:
![]()









