
- •Корпускулярно-волновой дуализм микрообъектов
- •Элементы квантовой механики
- •Квантовая теория свободных электронов в металле
- •Введение в теорию твердых тел
- •Основы физики лазеров
- •Элементы физики ядра и элементарных частиц
- •§ 1. Краткие исторические сведения
- •§ 2. Тепловое излучение
- •§ 3. Излучение абсолютно черного тела. Закон Кирхгофа.
- •Итоги лекции n 1
- •Лекция n 2 Проблема излучения абсолютно черного тела. Формула Планка. Закон Стефана-Больцмана, закон Вина § 1. Проблема излучения абсолютно черного тела. Формула Планка
- •§ 2. Закон Стефана-Больцмана и закон Вина
- •Итоги лекции n 2
- •Лекция n 3 Проблема фотоэффекта. Уравнение Эйнштейна для фотоэффекта § 1. Проблема фотоэффекта
- •§ 2. Уравнение Эйнштейна для фотоэффекта
- •Итоги лекции n 3
- •Лекция n 4 Боровская теория атома водорода Спектр излучения атома водорода в теории Бора § 1. Боровская теория атома водорода
- •Первый постулат Бора:
- •Второй постулат Бора:
- •§ 2. Спектры излучения атома водорода в теории Бора
- •Итоги лекции n 4
- •Корпускулярно-волновой дуализм микрообъектов
- •Лекция n 5 Свойства фотонов. Вероятностная интерпретация плотности энергии и интенсивности электромагнитной волны
- •§ 1. Свойства фотонов
- •2. Масса фотона
- •3. Энергия фотона
- •§ 2. Неделимость фотона
- •§ 3. Интерференция одиночных фотонов
- •§ 4. Вероятностная интерпретация плотности энергии и интенсивности электромагнитной волны
- •Итоги лекции n 5
- •§ 1. Гипотеза де Бройля. Волновые свойства электронов
- •Лекция n 6 § 2. Дифракция одиночных электронов
- •§ 3. Волновая функция и волна де Бройля
- •§ 4. Соотношения неопределенностей
- •Итоги лекции n 6
- •§ 2. Понятия об операторах физических величин
- •§ 3. Решение уравнения Шредингера для простейших случаев: свободная частица и частица в бесконечно глубокой одномерной потенциальной яме
- •§ 2. Квантовые числа
- •§ 3. Спектры атома водорода в теории Шредингера
- •§ 4. Волновая функция основного состояния атома водорода
- •Итоги лекции n 8
- •§ 2. Физические основы периодической системы элементов д. И. Менделеева
- •§ 3. Молекула
- •§ 4. Объяснение температурной зависимости теплоемкостей газов
- •Итоги лекции n 9
- •§ 1. Электронный газ в модели одномерной бесконечно глубокой ямы
- •§ 2. Электронный газ в модели бесконечно глубокой трехмерной потенциальной ямы
- •Итоги лекции n 10
- •Элементы квантовой статистики
- •Лекция n 11
- •§2. Анализ функции f(e)
- •Итоги лекции n 11
- •Лекция n 12 Результаты квантовой теории электропроводности. Термоэлектронная эмиссия. Бозоны. Распределение Бозе-Эйнштейна § 1. Результаты квантовой теории электропроводности металла
- •§ 2. Термоэлектронная эмиссия
- •§ 3. Бозоны. Распределение Бозе-Эйнштейна
- •Итоги лекции n 12
- •§ 2. Диэлектрики и полупроводники
- •§ 3. Собственная проводимость полупроводников
- •§ 2. Акцепторные примеси. Полупроводники p-типа
- •§ 3. Электронно-дырочный переход. Полупроводниковый диод
- •§ 4. Полупроводниковый триод - транзистор
- •Основы физики лазеров лекция n 15
- •§ 1. Вводные сведения
- •§ 2. Вынужденное (стимулированное) излучение
- •§ 3. Состояние с инверсией населенности
- •§ 4. Оптический резонатор
- •§ 5. Способы создания инверсии населенности
- •§ 6. Виды лазеров и их применение
- •§ 2. Дефект массы и энергия связи атомного ядра. Ядерные силы
- •§ 1. Некоторые сведения из истории открытия деления ядра урана
- •§ 2. Цепная ядерная реакция. Ядерная бомба
- •§ 3. Ядерный реактор
- •§ 4. Реакция синтеза атомных ядер. Проблема управляемых термоядерных реакций
- •Итоги лекции n 17
- •§ 1. Радиоактивность. Историческое введение
- •§ 2. Закон радиоактивного распада
- •§ 3. Взаимодействие радиоактивного излучения с веществом
- •§ 4. Методы регистрации ионизирующих излучений
- •Итоги лекции n 18
§ 4. Волновая функция основного состояния атома водорода
Для основного состояния атома водорода квантовые числа n, l, ml имеют следующие значения:
n = 1, l = 0, ml = 0.
Это состояние обозначают 1s. Уравнение Шредингера имеет для 1s состояния решение ψnim = ψ100 которое зависит только от расстояния r между ядром и электроном:
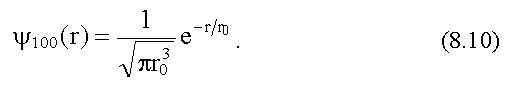
Здесь
![]() - первый боровский радиус.
- первый боровский радиус.
В соответствии с вероятностным смыслом волновой функции вероятность dw обнаружить электрон в объеме dV:

Отметим, что dw зависит от выбранной нами формы элементарного объема dV.
Если взять dV в форме прямоугольного параллелепипеда, т.е. dV = dxdydz и обозначить через dw соответствующую вероятность, то

В этом случае плотность вероятности обнаружить электрон в объеме параллелепипеда dV = dxdydz будет равна

Плотность вероятности имеет максимальное значение (1/π03) при r = 0, график этой функции изображен на рисунке 8.3.
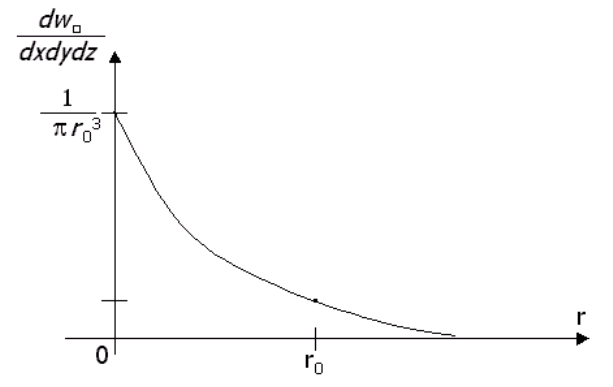
Рис. 8.3.
Так как волновая функция 1s состояния зависит только от r, то обычно элемент объема dV берут в виде сферического слоя радиуса r и толщиной dr. Как известно из геометрии, объем такого сферического слоя dV = 4πr2dr. Обозначим через dw0 соответствующую вероятность, тогда

Эта функция равна нулю при r = 0 и r → ∞. При r = r0 она имеет максимум, положение которого соответствует первой боровской орбите.

Рис. 8.4
Итоги лекции n 8
-
Формула (8.3) для энергии стационарных состояний атома водорода, полученная на основе уравнения Шредингера совпадает с аналогичной формулой (4.8), полученной в боровской теории атома водорода, т.е.:

Здесь n называется главным квантовым числом.
-
Волновые функции ψnlm(r, θ, φ) стационарных состояний атома водорода определяются тремя квантовыми числами:
1) n - главное квантовое число, оно определяет энергию стационарных состояний;
2) l - азимутальное (или орбитальное) квантовое число, оно определяет момент импульса электрона (см. (8.4), (8.5)):
![]()
при заданном n квантовое число l может принимать следующие значения
l = 0, 1, ...(n - 1).
3) ml - магнитное квантовое число, оно определяет проекцию момента импульса на выбранное направление в пространстве, скажем ось z (см. (8.6), (8.7):
![]()
при заданном l магнитное квантовое число mе может принимать следующие значения:
![]()
-
Появление в шредингеровской теории атома водорода квантования момента импульса L и его проекции Lz объясняет некоторые особенности спектров излучения и поглощения атома водорода, которые не могли быть объяснены теорией Бора.
-
Особенности спектров атома водорода связаны с тем, что фотон обладает собственным моментом импульса. Поэтому, вследствие закона сохранения момента импульса, момент импульса атома в процессах излучения и поглощения фотонов меняется. С наибольшей интенсивностью идут такие переходы, в которых выполняется следующее правило отбора для квантового числа l (см. (8.9)):
![]()
-
Шредингеровская теория атома водорода позволяет учесть влияние на энергетические уровни (а следовательно и на спектры излучения и поглощения) магнитного поля (эффект Зеемана) и электрического поля (эффект Штарка).
-
Шредингеровская теория атома водорода позволяет объяснить тонкую и сверхтонкую структуры спектров атома водорода на основе представления о собственном (спиновом) моменте импульса электрона.
ЛЕКЦИЯ N 9
Спин электрона. Принцип Паули. Физические основы периодической системы Д.И. Менделеева. Молекула. Объяснение температурной зависимости теплоемкостей газов
§ 1. Спин электрона. Принцип Паули. Фермионы и бозоны.
Как уже упоминалось в конце § 3 предыдущей лекции, спектральные линии атома водорода обнаруживают тонкую структуру. Тонкая структура присуща спектрам всех атомов. Для объяснения причин возникновения тонкой структуры американские физики Гаудсмит и Уленбек выдвинули в 1925 г. гипотезу о том, что электрон обладает собственным моментом импульса - спином Ls, не связанным с движением электрона в пространстве. Модуль собственного момента импульса определяется спиновым квантовым числом s:
![]()
Для электрона s = 1/2.
Проекция спина на ось z, Lsz, квантуется
![]()
здесь ms - магнитное спиновое квантовое число. Для электрона

Квантовое состояние электрона в любом атоме задается четырьмя квантовыми числами:
главным n (n = 1, 2, 3...);
азимутальным l (l = 0, 1, 2, ...n-1);
магнитным ml (ml = -l,... -1, 0, 1 ... +l); (9.4)
спиновым ms (ms = +1/2, -1/2).
О физическом смысле первых трех квантовых чисел сказано в § 2 предыдущей лекции, о последнем - только что.
Энергия состояния зависит главным образом от квантовых чисел n и l. Есть слабая зависимость энергии от ml и ms, т.к. эти квантовые числа определяют взаимодействие между орбитальным и спиновым магнитными моментами электрона. Это взаимодействие приводит к появлению тонкой структуры спектров.
Принцип Паули утверждает, что в квантовой системе две тождественные частицы с полуцелым спином не могут находиться в одном и том же квантовом состоянии, т.е.
![]()
Этот принцип был сформулирован в 1925 г. швейцарским физиком В. Паули для электронов в атоме, а затем распространен на любые частицы с полуцелым спином - фермионы. К фермионам относятся электрон, протон, нейтрон.
Частицы с целым спином носят название бозонов. К бозонам относятся фотон (спин s = 1), мезон, составные частицы из четного числа фермионов, например,α -частица - ядро атома 42He. Бозоны могут находиться в одинаковом квантовом состоянии в неограниченном количестве.
