
- •Часть 1
- •Изучаемые вопросы:
- •1. Предмет химии. Значение химии в изучении природы и развитии техники
- •Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
- •2. Основные количественные законы химии
- •Вопросы для самоконтроля
- •Литература
- •Лекция 3-5 (6 ч)
- •Тема 3. Агрегатное состояние вещества
- •Изучаемые вопросы:
- •3.1. Общая характеристика агрегатного состояния вещества
- •3.2. Газообразное состояние вещества. Законы идеальных газов. Реальные газы
- •3.3. Характеристика жидкого состояния вещества
- •3.4. Характеристика твёрдого состояния
- •Характеристики некоторых веществ
- •3.5. Типы кристаллических решёток
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекция 6-8 (6 ч)
- •Тема 1. Строение вещества. Периодическая система элементов д. И. Менделеева
- •Изучаемые вопросы:
- •1.1. Современная модель строения атома
- •1.2. Квантовые числа
- •Орбитальное квантовое число 0 1 2 3 4
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодические свойства элементов
- •1.5. Периодическая система элементов д. И. Менделеева
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 9-11 (6 ч)
- •Тема 2. Химическая связь и взаимодействия между молекулами
- •Изучаемые вопросы:
- •2.1. Общая характеристика химической связи
- •2.2. Типы химической связи
- •2.3.Типы межмолекулярных взаимодействий
- •2.4. Пространственная структура молекул
- •Число гибридных орбиталей равно числу исходных. При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекции 12-13 (4 ч)
- •Тема 4. Энергетика химических процессов
- •Изучаемые вопросы:
- •4.1. Общие понятия термодинамики
- •4.2. Первый закон (начало) термодинамики. Внутренняя энергия системы. Энтальпия системы
- •4.3. Термохимия. Тепловые эффекты химических реакций
- •4.4. Закон Гесса и следствия из него
- •I путь.
- •II путь.
- •4.5. Основные формулировки второго закона (начала) термодинамики
- •4.6. Принцип работы тепловой машины. Кпд системы
- •4.7. Свободная и связанная энергии. Энтропия системы
- •4.8. Энергия Гиббса, энергия Гельмгольца и направленность химических реакций
- •Для определения температуры (Тр), выше которой происходит смена знака энергии Гиббса реакции, можно воспользоваться условием
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 5. Химическая кинетика и катализ
- •Изучаемые вопросы:
- •5.1. Понятие о химической кинетике
- •5.2. Факторы, влияющие на скорость химических реакций. Закон действующих масс
- •5.3. Классификация химических реакций по молекулярности и по порядку
- •5.4. Кинетические уравнения реакци первого и второго порядка
- •Поле интегрирования
- •5.5. Теория активизации молекул. Уравнение Аррениуса
- •5.6. Особенности каталитических реакций. Теории катализа
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 16 (2 ч)
- •Тема 6. Химическое равновесие
- •Изучаемые вопросы:
- •6.1. Обратимые и не обратимые реакции. Признаки химического равновесия
- •6.2. Константа химического равновесия
- •6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
- •6.4. Правило фаз Гиббса. Диаграмма состояния воды
- •Правило фаз для воды имеет вид
- •6.5. Понятие о химическом сродстве веществ. Уравнения изотермы, изобары и изохоры химических реакций
- •Вопросы для самоконтроля:
- •Лекции 15-17 (6 ч)
- •Тема 7. Растворы. Дисперсные системы
- •Изучаемые вопросы:
- •7.1. Сольватная (гидратная) теория растворения
- •7.2. Общие свойства растворов
- •7.3. Типы жидких растворов. Растворимость
- •7.4. Свойства слабых электролитов
- •7.5. Свойства сильных электролитов
- •7.6. Классификация дисперсных систем
- •7.7. Получение коллоидно-дисперсных систем
- •7.8. Устойчивость коллоидных растворов. Коагуляция. Пептизация
- •7.9. Свойства коллоидно-дисперсных систем
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 13 (2ч)
- •Тема 8. Кислотно-основные и окислительно-восстановительные свойства вещества
- •Изучаемые вопросы:
- •8.1. Особенности обменных процессов
- •8.2. Особенности окислительно-восстановительных процессов
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 9. Электрохимические системы
- •Изучаемые вопросы:
- •9.4. Электродвижущая сила гальванического элемента.
- •9.1. Общие понятия электрохимии. Проводники первого и второго рода
- •9.2. Понятие об электродном потенциале
- •9.3. Гальванический элемент Даниэля-Якоби
- •9.4. Электродвижущая сила гальванического элемента
- •9.5. Классификация электродов
- •9.6. Поляризация и перенапряжение
- •9.7. Электролиз. Законы Фарадея
- •9.8. Коррозия металлов
6.2. Константа химического равновесия
Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
аA + вB сC + dD,
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
пр = k1CАаCВв (6.1)
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
обр = k2CCсCDd (6.2)
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой пр = обр, следовательно
k1CАаCВв = k2CCсCDd (6.3)
Перенесем константы скорости в одну сторону, а концентрации в другую:
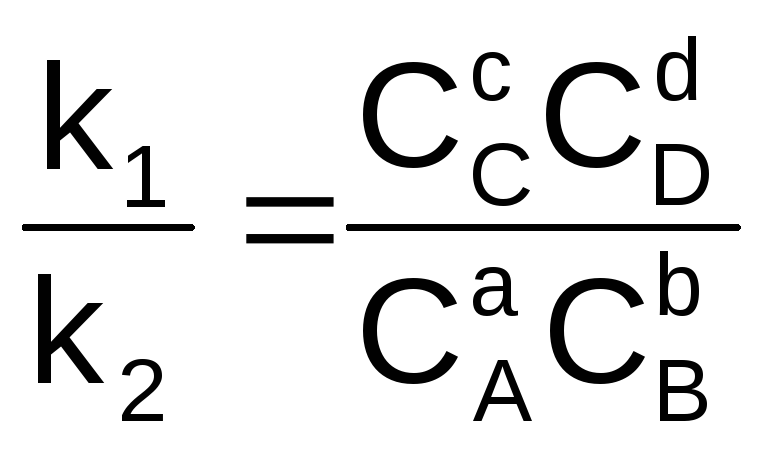 (6.4)
(6.4)
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
![]() (6.5)
(6.5)
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
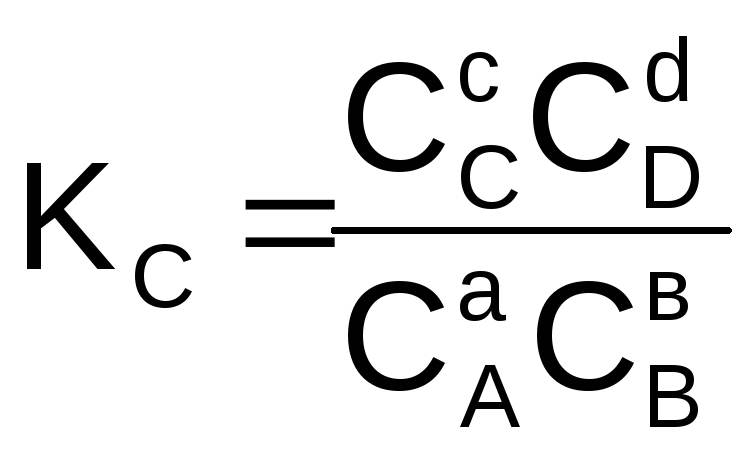 (6.6)
(6.6)
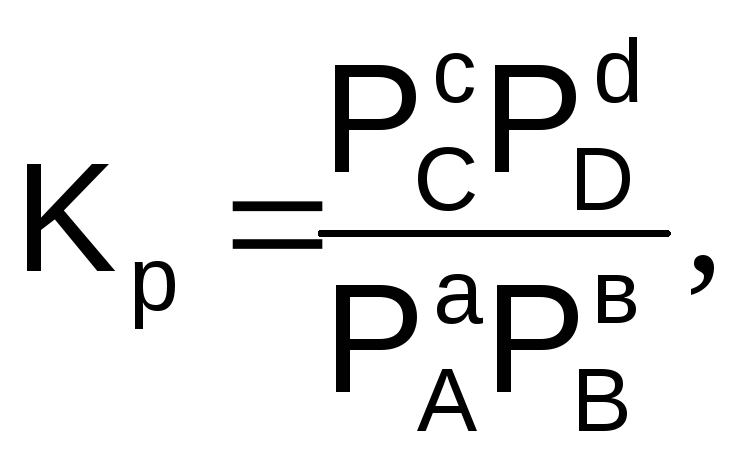 (6.7)
(6.7)
где РС, РD, РА и РВ – равновесные давления участников реакции.
Используя уравнение Клапейрона-Менделеева, можно определить связь между KР и KС
рV = nRT (6.8)
Перенесем объем в правую сторону
р =
![]() RT,
т. е. р = CRT
(6.9)
RT,
т. е. р = CRT
(6.9)
Подставим уравнение (6.9) в (6.7), для каждого реагента и упростим
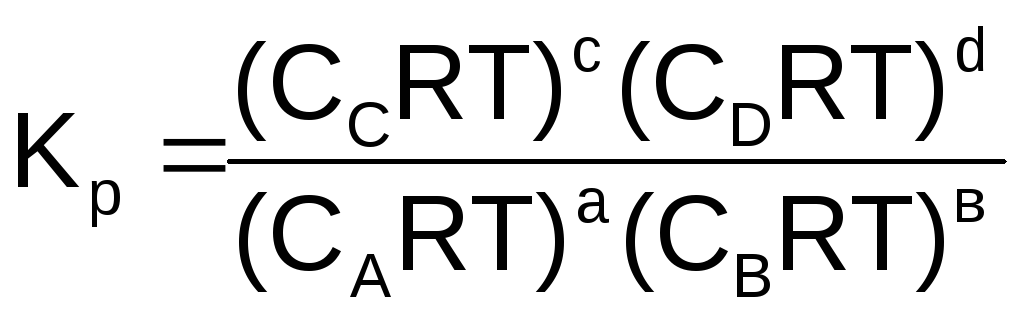
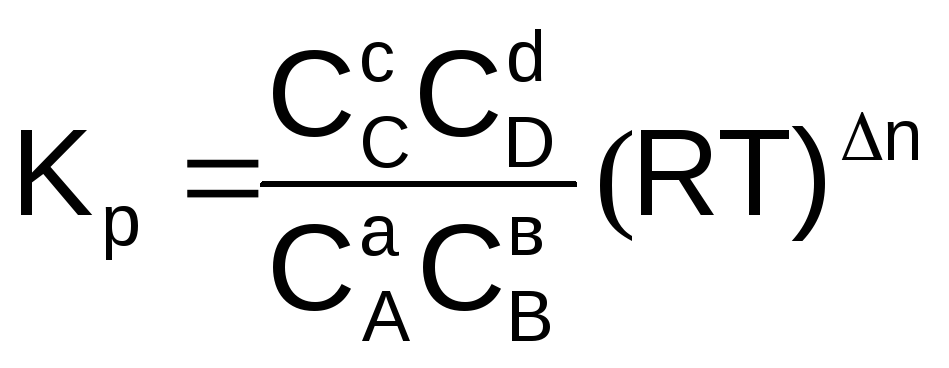 ,
(6.10)
,
(6.10)
где n – изменение числа молей газообразных участников реакции
n = (с + d) – (а + в) (6.11)
Следовательно,
KР = КС(RT)n (6.12)
Из уравнения (6.12) видно, что KР = КС, если не меняется количество молей газообразных участников реакции (n = 0) или газы в системе отсутствуют.
Необходимо отметить, что в случае гетерогенного процесса концентрацию твердой или жидкой фазы в системе не учитывают.
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
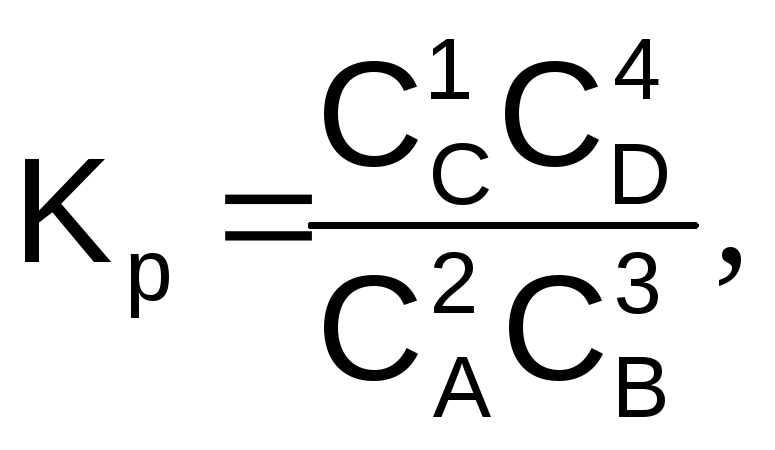 (6.13)
(6.13)
а если D – твердое, то
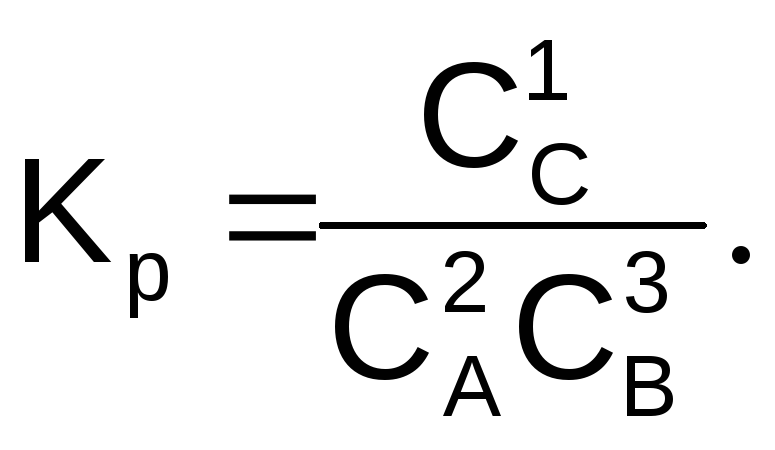 (6.14)
(6.14)
Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической возможности и глубине протекания химической реакции.
Если K > 1, то данная реакция протекает со значительным выходом продуктов реакции; если K > 104, то реакция необратима; если K < 1, то такая реакция нетехнологична; если K < 10-4, то такая реакция невозможна.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
