
- •Часть 1
- •Изучаемые вопросы:
- •1. Предмет химии. Значение химии в изучении природы и развитии техники
- •Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
- •2. Основные количественные законы химии
- •Вопросы для самоконтроля
- •Литература
- •Лекция 3-5 (6 ч)
- •Тема 3. Агрегатное состояние вещества
- •Изучаемые вопросы:
- •3.1. Общая характеристика агрегатного состояния вещества
- •3.2. Газообразное состояние вещества. Законы идеальных газов. Реальные газы
- •3.3. Характеристика жидкого состояния вещества
- •3.4. Характеристика твёрдого состояния
- •Характеристики некоторых веществ
- •3.5. Типы кристаллических решёток
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекция 6-8 (6 ч)
- •Тема 1. Строение вещества. Периодическая система элементов д. И. Менделеева
- •Изучаемые вопросы:
- •1.1. Современная модель строения атома
- •1.2. Квантовые числа
- •Орбитальное квантовое число 0 1 2 3 4
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодические свойства элементов
- •1.5. Периодическая система элементов д. И. Менделеева
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 9-11 (6 ч)
- •Тема 2. Химическая связь и взаимодействия между молекулами
- •Изучаемые вопросы:
- •2.1. Общая характеристика химической связи
- •2.2. Типы химической связи
- •2.3.Типы межмолекулярных взаимодействий
- •2.4. Пространственная структура молекул
- •Число гибридных орбиталей равно числу исходных. При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекции 12-13 (4 ч)
- •Тема 4. Энергетика химических процессов
- •Изучаемые вопросы:
- •4.1. Общие понятия термодинамики
- •4.2. Первый закон (начало) термодинамики. Внутренняя энергия системы. Энтальпия системы
- •4.3. Термохимия. Тепловые эффекты химических реакций
- •4.4. Закон Гесса и следствия из него
- •I путь.
- •II путь.
- •4.5. Основные формулировки второго закона (начала) термодинамики
- •4.6. Принцип работы тепловой машины. Кпд системы
- •4.7. Свободная и связанная энергии. Энтропия системы
- •4.8. Энергия Гиббса, энергия Гельмгольца и направленность химических реакций
- •Для определения температуры (Тр), выше которой происходит смена знака энергии Гиббса реакции, можно воспользоваться условием
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 5. Химическая кинетика и катализ
- •Изучаемые вопросы:
- •5.1. Понятие о химической кинетике
- •5.2. Факторы, влияющие на скорость химических реакций. Закон действующих масс
- •5.3. Классификация химических реакций по молекулярности и по порядку
- •5.4. Кинетические уравнения реакци первого и второго порядка
- •Поле интегрирования
- •5.5. Теория активизации молекул. Уравнение Аррениуса
- •5.6. Особенности каталитических реакций. Теории катализа
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 16 (2 ч)
- •Тема 6. Химическое равновесие
- •Изучаемые вопросы:
- •6.1. Обратимые и не обратимые реакции. Признаки химического равновесия
- •6.2. Константа химического равновесия
- •6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
- •6.4. Правило фаз Гиббса. Диаграмма состояния воды
- •Правило фаз для воды имеет вид
- •6.5. Понятие о химическом сродстве веществ. Уравнения изотермы, изобары и изохоры химических реакций
- •Вопросы для самоконтроля:
- •Лекции 15-17 (6 ч)
- •Тема 7. Растворы. Дисперсные системы
- •Изучаемые вопросы:
- •7.1. Сольватная (гидратная) теория растворения
- •7.2. Общие свойства растворов
- •7.3. Типы жидких растворов. Растворимость
- •7.4. Свойства слабых электролитов
- •7.5. Свойства сильных электролитов
- •7.6. Классификация дисперсных систем
- •7.7. Получение коллоидно-дисперсных систем
- •7.8. Устойчивость коллоидных растворов. Коагуляция. Пептизация
- •7.9. Свойства коллоидно-дисперсных систем
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 13 (2ч)
- •Тема 8. Кислотно-основные и окислительно-восстановительные свойства вещества
- •Изучаемые вопросы:
- •8.1. Особенности обменных процессов
- •8.2. Особенности окислительно-восстановительных процессов
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 9. Электрохимические системы
- •Изучаемые вопросы:
- •9.4. Электродвижущая сила гальванического элемента.
- •9.1. Общие понятия электрохимии. Проводники первого и второго рода
- •9.2. Понятие об электродном потенциале
- •9.3. Гальванический элемент Даниэля-Якоби
- •9.4. Электродвижущая сила гальванического элемента
- •9.5. Классификация электродов
- •9.6. Поляризация и перенапряжение
- •9.7. Электролиз. Законы Фарадея
- •9.8. Коррозия металлов
5.2. Факторы, влияющие на скорость химических реакций. Закон действующих масс
На скорость химических реакций оказывают влияние следующие факторы: природа и концентрации реагирующих веществ; температура, природа растворителя, присутствие катализатора и т.д.
Зависимость скорости химических реакций от концентрации устанавливает закон действующих (действия) масс, сформулированный Гульдбергом и Вааге (1867), этот закон и является основным законом кинетики: скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрического коэффициента данного вещества в уравнении реакции.
Для гомогенной реакции общего вида
аA + вB → сC + dD
пр = k1CАа CВв, (5.4)
обр = k2Cсс CDd, (5.5)
где пр – скорость прямой реакции;
обр – скорость обратной реакции;
СА,CB,CC и CD – концентрации реагирующих веществ, например, моль/дм3;
а, в, с, и d – стехиометрические коэффициенты участников реакции;
k1 и k2 – коэффициенты пропорциональности, названные константой скорости химической реакции.
Для газов вместо концентрации можно использовать давления
пр = k1РАа РВв.
Определим физический смысл константы скорости. Примем концентрации веществ А и В равными 1 моль/дм3 (СА = CB = 1 моль/дм3), тогда пр = k1. Таким образом, константа скорости – это скорость реакции, если концентрации реагирующих веществ равны 1 моль/дм3. Константа скорости зависит от тех же факторов, что и скорость, за исключением концентрации веществ. Причем, чем больше величина константы скорости, тем больше скорость процесса. Константу скорости можно найти опытным путем или посчитать, используя уравнения, описывающие механизм химической реакции.
Зависимость константы скорости (и скорости) процесса от температуры определяет приближенное правило Вант-Гоффа: увеличение температуры на каждые 10 ОС увеличивает скорость процесса в 2 - 4 раза.
Аналитическое выражение этого правила в общем виде:
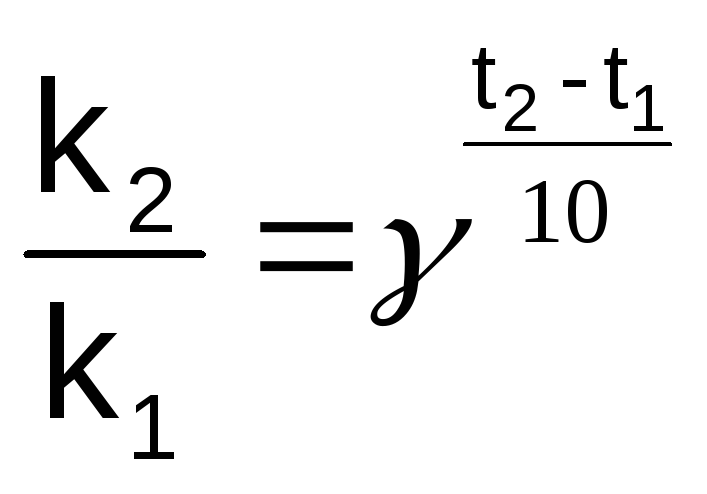 (5.6)
(5.6)
где k1 и k2 – константы скорости при температуре t1 и t2,
γ – температурный коэффициент Вант-Гоффа (γ = 2 4).
Правило Вант-Гоффа применяют при изменении температуры ниже 30 ºС. При более высоких изменениях температуры используют уравнение Аррениуса
lnk
= B
–
![]() ,
(5.7)
,
(5.7)
где А и В – постоянные величины для данной реакции.
Скорость гетерогенных реакций имеет ряд особенностей. Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством (поверхностью). Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. Вместо концентрации твердой фазы в уравнение вводят площадь поверхности этого вещества (S)
пр = k1CАа SВ (5.8)
Второй особенностью гетерогенных процессов является зависимость скорости реакции от скорости подвода реагента в зону химической реакции, то есть, от скорости диффузии реагентов. Скорость диффузии увеличивают перемешиванием реакционной среды.
Скорость гетерогенной обратимой реакции определяется разностью скоростей прямой и обратной реакции (реакции = пр - обр) – это третья особенность гетерогенных процессов.
