
- •Часть 1
- •Изучаемые вопросы:
- •1. Предмет химии. Значение химии в изучении природы и развитии техники
- •Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
- •2. Основные количественные законы химии
- •Вопросы для самоконтроля
- •Литература
- •Лекция 3-5 (6 ч)
- •Тема 3. Агрегатное состояние вещества
- •Изучаемые вопросы:
- •3.1. Общая характеристика агрегатного состояния вещества
- •3.2. Газообразное состояние вещества. Законы идеальных газов. Реальные газы
- •3.3. Характеристика жидкого состояния вещества
- •3.4. Характеристика твёрдого состояния
- •Характеристики некоторых веществ
- •3.5. Типы кристаллических решёток
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекция 6-8 (6 ч)
- •Тема 1. Строение вещества. Периодическая система элементов д. И. Менделеева
- •Изучаемые вопросы:
- •1.1. Современная модель строения атома
- •1.2. Квантовые числа
- •Орбитальное квантовое число 0 1 2 3 4
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодические свойства элементов
- •1.5. Периодическая система элементов д. И. Менделеева
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 9-11 (6 ч)
- •Тема 2. Химическая связь и взаимодействия между молекулами
- •Изучаемые вопросы:
- •2.1. Общая характеристика химической связи
- •2.2. Типы химической связи
- •2.3.Типы межмолекулярных взаимодействий
- •2.4. Пространственная структура молекул
- •Число гибридных орбиталей равно числу исходных. При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
- •Вопросы для самоконтроля:
- •Вопросы для самостоятельной работы:
- •Литература:
- •Лекции 12-13 (4 ч)
- •Тема 4. Энергетика химических процессов
- •Изучаемые вопросы:
- •4.1. Общие понятия термодинамики
- •4.2. Первый закон (начало) термодинамики. Внутренняя энергия системы. Энтальпия системы
- •4.3. Термохимия. Тепловые эффекты химических реакций
- •4.4. Закон Гесса и следствия из него
- •I путь.
- •II путь.
- •4.5. Основные формулировки второго закона (начала) термодинамики
- •4.6. Принцип работы тепловой машины. Кпд системы
- •4.7. Свободная и связанная энергии. Энтропия системы
- •4.8. Энергия Гиббса, энергия Гельмгольца и направленность химических реакций
- •Для определения температуры (Тр), выше которой происходит смена знака энергии Гиббса реакции, можно воспользоваться условием
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 5. Химическая кинетика и катализ
- •Изучаемые вопросы:
- •5.1. Понятие о химической кинетике
- •5.2. Факторы, влияющие на скорость химических реакций. Закон действующих масс
- •5.3. Классификация химических реакций по молекулярности и по порядку
- •5.4. Кинетические уравнения реакци первого и второго порядка
- •Поле интегрирования
- •5.5. Теория активизации молекул. Уравнение Аррениуса
- •5.6. Особенности каталитических реакций. Теории катализа
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 16 (2 ч)
- •Тема 6. Химическое равновесие
- •Изучаемые вопросы:
- •6.1. Обратимые и не обратимые реакции. Признаки химического равновесия
- •6.2. Константа химического равновесия
- •6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
- •6.4. Правило фаз Гиббса. Диаграмма состояния воды
- •Правило фаз для воды имеет вид
- •6.5. Понятие о химическом сродстве веществ. Уравнения изотермы, изобары и изохоры химических реакций
- •Вопросы для самоконтроля:
- •Лекции 15-17 (6 ч)
- •Тема 7. Растворы. Дисперсные системы
- •Изучаемые вопросы:
- •7.1. Сольватная (гидратная) теория растворения
- •7.2. Общие свойства растворов
- •7.3. Типы жидких растворов. Растворимость
- •7.4. Свойства слабых электролитов
- •7.5. Свойства сильных электролитов
- •7.6. Классификация дисперсных систем
- •7.7. Получение коллоидно-дисперсных систем
- •7.8. Устойчивость коллоидных растворов. Коагуляция. Пептизация
- •7.9. Свойства коллоидно-дисперсных систем
- •Вопросы для самоконтроля:
- •Литература:
- •Лекция 13 (2ч)
- •Тема 8. Кислотно-основные и окислительно-восстановительные свойства вещества
- •Изучаемые вопросы:
- •8.1. Особенности обменных процессов
- •8.2. Особенности окислительно-восстановительных процессов
- •Вопросы для самоконтроля:
- •Литература:
- •Лекции 14-15 (4 ч)
- •Тема 9. Электрохимические системы
- •Изучаемые вопросы:
- •9.4. Электродвижущая сила гальванического элемента.
- •9.1. Общие понятия электрохимии. Проводники первого и второго рода
- •9.2. Понятие об электродном потенциале
- •9.3. Гальванический элемент Даниэля-Якоби
- •9.4. Электродвижущая сила гальванического элемента
- •9.5. Классификация электродов
- •9.6. Поляризация и перенапряжение
- •9.7. Электролиз. Законы Фарадея
- •9.8. Коррозия металлов
Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
В природе элементы за редким исключением существуют в виде смесей из нескольких изотопов. Это ведет к тому, что атомный вес природного элемента несколько отличается от атомного веса любого из его чистых изотопов. Легче всего это понять из таблицы 2-2, где приведены атомные веса природных элементов и их изотопный состав.
Таблица 2-2. Символы, названия, атомные веса и природный изотопный состав некоторых химических элементов.
|
Элемент и его символ с массовым числом и зарядом ядра |
Латинское название (как читается) |
Атомный вес природного элемента |
Атомный вес изотопов |
Содержание изотопов в природном элементе, % |
|
Водород 11H 21H (D) |
Hydrogenium (гидрогениум) |
1,0079 |
...... 1,0078 2,0140 |
...... 99,984 0,0156 |
|
Углерод 126C 136C |
Carboneum (карбониум) |
12,011 |
...... 12,00000 13,00335 |
...... 98,892 1,108 |
|
Азот 147N 157N |
Nitrogenium (нитрогениум) |
14,0067 |
...... 14,00307 15,00011 |
...... 99,635 0,365 |
|
Кислород 168O 178O 188O |
Oxygenium (оксигениум) |
15,9994 |
...... 15,99491 16,9991 17,9992 |
...... 99,759 0,037 0,204 |
|
Натрий 2311Na |
Natrium (натриум) |
22,9898 |
...... 22,9898 |
...... 100 |
|
Хлор 3517Cl 3717Cl |
Chlorum (хлорум) |
35,453 |
...... 34,96885 36,9658 |
...... 75,53 24,47 |
Из таблицы видно, что средний измеренный атомный вес найденного в природе элемента зависит от того, сколько в нем содержится разных изотопов.
Итак, в первой колонке таблицы 2-2 приведено русское название элемента. Ниже - латинский символ элемента, связанный обычно с его латинским названием. Слева вверху от символа элемента указываются массовое число (сумма протонов и нейтронов в ядре), а слева внизу - заряд ядра атома (количество протонов). Например:
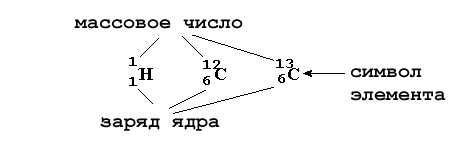
Как видно из таблицы 2-2, атомные веса элементов, найденных в природе в виде единственного изотопа (например, натрия), в точности равны атомному весу этого изотопа. Иначе обстоит дело с элементами, которые существуют на Земле в виде нескольких изотопов (например, хлор, кислород): их атомный вес зависит от того, какой изотоп этого элемента наиболее распространен и сколько в нем "примесей" других изотопов этого элемента.
Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности.
Например, элемент хлор в природе находится в виде двух изотопов: хлор-35 и хлор-37. Их содержание составляет 75,53% и 24,47% (см. табл. 2-2). Если общее содержание двух изотопов хлора в сумме принять за единицу, то одного из них - примерно 0,75 и другого - примерно 0,25 (в долях единицы). Тогда атомный вес природной смеси двух изотопов хлора округленно равен:
34,97 0,75 + 36,96 0,25 = 35,5.
Можно решать и обратную задачу. Допустим, точно известно, что природный хлор состоит из двух изотопов 35Cl и 37Cl. Найденный в эксперименте атомный вес природного хлора составил 35,5. Сколько каждого изотопа содержится в природном хлоре? Если принять сумму изотопов за единицу, а содержание, например, 35Cl за x, то содержание изотопа 37Cl составит (1 - x). Тогда: 35x + 37(1 - x) = 35,5. Решив это простое уравнение, получим содержание изотопа 35Cl равным 0,75 или 75%.
Есть еще один важный фактор, влияющий (хотя и в меньшей степени) на атомный вес элемента - дефект массы. Внимательный читатель мог заметить некоторые "странности" в табл. 2-2. Например, атомная масса единственного изотопа натрия 2311Na немного меньше, чем 23 а.е.м. Массы протона и нейтрона чуть больше 1 а.е.м. Почему же атом натрия, содержаший в своем ядре 11 протонов и 12 нейтронов имеет массу меньше 23 (22,9898 а.е.м.)? То же явление хорошо заметно для изотопов кислорода и хлора (см. табл. 2-2). Дело в том, что связывание между собой одноименно заряженных протонов в ядрах атомов требует больших затрат энергии. Нейтроны тоже участвуют в этом связывании, выполняя роль своеобразного ядерного "клея". При этом часть массы протонов и нейтронов переходит в энергию связывания нуклонов в ядре. Такая потеря массы протонов и нейтронов, возникающая в результате их связывания, называется дефектом массы.
Дефект массы - уменьшение массы атома по сравнению с суммарной массой всех отдельно взятых составляющих его элементарных частиц, обусловленное энергией их связи в атоме.
Если "разобрать" ядро атома на отдельные протоны и нейтроны (например, с помощью ядерной реакции), то их масса вновь примет именно те значения, которые нам уже известны: 1,00728 а.е.м. для протона и 1,00867 а.е.м. для нейтрона.
Дефект массы является следствием универсального соотношения E = Mc2, вытекающего из теории относительности А. Эйнштейна, где E - полная энергия системы, c = 3.1010 см/сек - скорость света в пустоте, M - масса системы (в нашем случае - атома). Тогда M = Е/c2, где M - дефект массы, а E - энергия связи нуклонов в ядре, т.е. энергия, которую необходимо затратить для разделения ядра атома на отдельные протоны и нейтроны. Таким образом, чем больше дефект массы, тем больше энергия связывания нуклонов в ядре и тем устойчивее ядро атома элемента. С увеличением числа протонов в ядре (и массового числа) дефект массы сначала возрастает от нуля (для 1H) до максимума (у 64Ni), а затем постепенно убывает для более тяжелых элементов.
Нет никакой необходимости запоминать изотопный состав, заряд ядра, массовые числа и атомные веса разных элементов. Эти значения всегда можно найти в справочниках. Важно понимать физический смысл этих величин. В химии традиционно используются не абсолютные значения атомных масс, а относительные. Относительной атомной массой Аr химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода-12. Относительной молекулярной массой Мr химического вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода-12.
Любое химическое вещество характеризуется количеством вещества. Количество вещества – это число структурных элементов (атомов, молекул, ионов и др.) в системе. Единицей измерения количества вещества является моль. Моль – количество вещества системы, которое содержит столько структурных элементов (молекул, атомов, ионов, электронов и т.д.), сколько атомов содержится в 0,012 кг углерода-12. Массу одного моля называют молярной массой. Единица измерения – г/моль или кг/моль.
Познание химии как одной из важнейших фундаментов естественных наук необходимо для формирования научного мировоззрения. Изучение химии играет важную роль образного мышления в творческом росте будущих специалистов. Важную роль играет химия в жизни каждого человека, в его практической деятельности. Особенно велико значение науки о веществе в технике, развитие которой немыслимо без понимания процессов превращения веществ. Глубокое понимание законов химии, их применение позволяют как совершенствовать существующие, так и создавать новые процессы, машины, установки и приборы. Химизация народного хозяйства является одним из важнейших путей интенсификации его развития.
Химические реакции широко используются во многих производственных процессах. Они (например, процессы окисления, коррозии и др.) протекают при работе установок, машин и приборов. Получение электроэнергии, топлива, металлов, различных материалов, продуктов питания и т.п. непосредственно связано с химическими реакциями. В настоящее время, например, электрическую и механическую энергии получают, в основном, преобразованием химической энергии природного топлива. В процессе преобразования происходят сложные химические реакции: горения, взаимодействия воды и ее примесей с металлами и т.п. Без понимания этих процессов невозможно обеспечить эффективную работу электростанций и двигателей внутреннего сгорания.
Использование химических реакций в ряде производственных процессов позволяет резко повышать производительность труда и качество продукции, получать новые материалы.
Понимание законов химии и их использование исключительно важно при решении проблемы повышения эффективности производства и качества продукции, так как ухудшение качества и надежности продукции во многих случаях вызывается нежелательными химическими процессами, например коррозией металлов, старением полимеров и т.п. Изучение механизмов химических реакций позволяет выбрать рациональные методы охраны окружающей среды, создавать новые безвредные процессы. Химизация любой отрасли народного хозяйства приносит большой экономический эффект.
Возросла роль химии в развитии электротехники, микроэлектроники, радиотехники, космической техники, автоматики и вычислительной техники. Для развития новой техники необходимы материалы с особыми свойствами, которых нет в природе: сверхчистые, сверхтвердые, сверхпроводящие, жаростойкие и т.п. Такие материалы поставляет современная химическая промышленность, поэтому можно понять важность изучения химии для любой специальности. В электротехнической промышленности, более 80 % продукции выпускается с применением полимерных материалов.
