
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
2.2 Электроды в потенциометрии
По своему назначению электроды делятся на два основных типа: индикаторные электроды (ИЭ) и электроды сравнения (ЭС).
2.2.1 Индикаторные электроды
Индикаторные электроды – это электроды, потенциал которых зависит от активности (концентрации) определяемых ионов. К индикаторным электродам предъявляются следующие требования:
1) потенциал ИЭ должен быть воспроизводим и достаточно быстро устанавливаться;
2) зависимость потенциала ИЭ от активности (концентрации) определяемых ионов должна строго соответствовать уравнению Нернста;
3) электрод должен быть химически устойчив в анализируемом растворе.
В качестве ИЭ в потенциометрии применяют металлические (в том числе и амальгамные) и мембранные электроды [1, 3].
2.2.1.1 Электроды первого рода
Металлические электроды изготавливают из различных металлов, способных давать обратимые полуреакции вида:

Потенциалы таких металлов как серебро, медь, ртуть, свинец, кадмий воспроизводимы и соответствуют уравнению Нернста. Так как выше приведённая реакция обратима, говорят, что металлические электроды обратимы относительно катиона. Их называют электродами первого рода. Этими же свойствами обладают и амальгамные электроды.
Другие металлы, например, железо, никель, кобальт, хром, вольфрам и др. не пригодны для изготовления индикаторных электродов. Они дают невоспроизводимые результаты, что объясняется напряжениями и деформациями в их кристаллической структуре или образованием оксидных плёнок на поверхности.
2.2.1.2 Электроды второго рода
Металлические индикаторные электроды могут быть использованы не только для определения собственных ионов в растворе. Они также чувствительны к анионам, образующим малорастворимые осадки с катионами этого металла. Состоит такой электрод из металла, покрытого слоем труднорастворимой соли этого металла, и погружённого в раствор, содержащий тот же анион, что и труднорастворимая соль электродного металла. Такими электродами являются хлорсеребряный, каломельный, меркурииодидный, сульфато-ртутный и другие электроды. Эти электроды обратимы относительно анионов, они называются электродами второго рода. Потенциал зависит от активности аниона малорастворимого соединения входящего в состав электрода. Используют электроды второго рода в реакциях осаждения в качестве индикаторных.
Серебряный
электрод, погружённый в раствор хлорида
калия, насыщенный хлоридом серебра,
образует систему:
 .
Называется такой электрод хлорсеребряным.
Потенциал его зависит от концентрации
хлорид-ионов в растворе. При включении
этого электрода в гальваническую цепь
на электроде устанавливаются равновесия:
.
Называется такой электрод хлорсеребряным.
Потенциал его зависит от концентрации
хлорид-ионов в растворе. При включении
этого электрода в гальваническую цепь
на электроде устанавливаются равновесия:
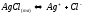 - в растворе;
- в растворе;
 для этой полуреакции
для этой полуреакции
 В.
Записав суммарное уравнение имеет вид:
В.
Записав суммарное уравнение имеет вид:
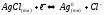
Эта
полуреакция протекает на хлорсеребряном
электроде и определяет его потенциал.
Здесь (и далее) приняв активность ( )
равной концентрации (
)
равной концентрации (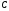 ),
потенциал электрода выражается формулой:
),
потенциал электрода выражается формулой:
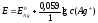
Учитывая,
что система содержит труднорастворимое
вещество, концентрация ионов
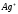 будет определяться отношением:
будет определяться отношением:
 ,
тогда уравнение Нернста примет вид:
,
тогда уравнение Нернста примет вид:

или
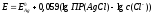
Сумму
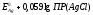 обозначают через
обозначают через
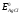 ,
считая её стандартным потенциалом
хлорсеребряного электрода. При вычислении
,
считая её стандартным потенциалом
хлорсеребряного электрода. При вычислении
 принимают
принимают
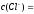 1 моль/л,
1 моль/л,
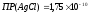 ,
получают
,
получают
 В. Формула вычисления
В. Формула вычисления
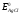 имеет вид:
имеет вид:
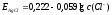
Таким образом, в электродной системе, содержащей металл и малорастворимую соль его в растворе хорошо растворимой соли с тем же анионом, изменение концентрации аниона, влияя на концентрацию катиона, вызывает изменение потенциала электрода. Обратимость электрода относительно аниона существует не в силу химических особенностей процессов на электродах, а лишь потому, что растворы солей насыщены.
Обратимость
относительно аниона свойственна также
многим газовым электродам, получающимся
при насыщении поверхности инертного
металла (например Pt)
газами, способными восстанавливаться
до состояния аниона (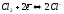 )
[4].
)
[4].
