
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
2.3 Прямая потенциометрия
Потенциометрический метод анализа по способу проведения его подразделяется на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Прямая потенциометрия основана на измерении потенциала индикаторного электрода и вычислении концентрации определяемого иона по уравнению Нернста.
Методика таких измерений проста и состоит только в сравнении потенциала индикаторного электрода в растворе определяемого вещества с потенциалом этого электрода в стандартном растворе того же вещества. Поскольку индикаторный электрод селективен по отношению к определяемому веществу, предварительное разделение не требуется. Данный метод легко автоматизировать [6].
Точность результатов прямых потенциометрических измерения ограничена ошибкой за счет диффузионного потенциала, достигающего иногда нескольких десятых долей вольта. Уменьшение ошибки измерений по указанной причине достигается использованием солевого мостина (электролитический клич, электролитический мостик), содержащего насыщенный раствор хлорида калия.
Погрешности метода прямой потенциометрии не превышают обычно 10%.
В практике прямой потенциометрии используются методы градуировочного (калибровочного) графика, добавок, метод калибровки электрода. Лучшие результаты дает метод добавок, относительная погрешность измерений при этом находится в интервале 1 – 2 %.
Потенциометрические измерения концентраций ионов водорода образуют метод, называемый "рН-метрией", а для других ионов "ионометрия". В этих методах, как было ранее указано, используются мембранные электроды.
2.4 Потенциометрическое титрование
Основано потенциометрическое титрование на определении точки эквивалентности по результатам потенциометрических измерений в ходе титрования.
Реакции в ячейке при потенциометрическом титровании должны протекать строго стехиометрически, достаточно быстро и до конца. Используется потенциометрическое титрование как для решения аналитических так и исследовательских задач. Например, для определения констант диссоциации слабых кислот и оснований, констант нестойкости комплексных ионов, произведения растворимости веществ, рН осаждения гидроксидов и др. Метод имеет ряд преимуществ по сравнению с химическим титриметрическим методом, так как допускает титрование окрашенных и мутных растворов, титрование нескольких компонентов в один прием, дает более точные результаты при работе с малыми концентрациями растворов. Относительная погрешность лежит в пределах.
Для проведения титрования собирается установка (рисунок 8).
Титрование включает измерение и запись потенциала ячейки (или показания рН) после каждого прибавления реагента. По мере приближения конечной точки порции титранта уменьшаются, при этом наблюдается большое изменение потенциала (рН).
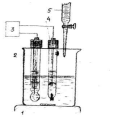
1 - магнитная мешалка;
2 - индикаторный электрод (стеклянный);
3 - рН-метр;
4 - электрод сравнения (насыщенный каломельный);
5 - бюретка.
Рисунок 8 – Установка для потенциометрического титрования
В точке эквивалентности происходит резкое изменение потенциала (скачок), после чего при дальнейшем прибавлении реагента потенциал изменяется незначительно.
Титрование заканчивается при получении нескольких значений потенциала (рН) мало отличающихся друг от друга. В ходе титрования для достижения равновесного потенциала электрода требуется выжидать некоторое время после прибавления каждой порции раствора титранта. Этому способствует и перемешивание раствора.
Для определения конечной точки титрования используют графики различных зависимостей:
а) рН (Е) - V (титранта);
б) Δ pH/ΔV (ΔE/ΔV) -V (титранта);
в) Δ2pH/ΔV2 (Δ2E/ΔV2) -V(титранта).
На примере титрования раствора бромида магния MgBr2 0,1000 н раствором нитрата ртути (II) показана форма записи результатов титрования (таблица 4) и графическое нахождение точки эквивалентности (рисунок 9).
Таблица 4 - Результаты титрования раствора бромида магния нитратом ртути
|
V (Hg(NO3)2), мл |
Е, В относ. нкэ |
ΔE/ΔV |
Δ2E/ΔV2 |
|
10 |
0,501 |
0,005 0,009 0,018 0,038 0,065 0,135 0,540 0,065 0,035 0,026 0,005 |
0,135 0,350 2,25 -2,38 -0,150 -0,055 |
|
15 |
0,526 |
||
|
18 |
0,552 |
||
|
19 |
0,570 |
||
|
19,5 |
0,587 |
||
|
19,7 |
0,602 |
||
|
19,9 |
0,629 |
||
|
20,1 |
0,737 |
||
|
20,3 |
0,750 |
||
|
20,5 |
0,757 |
||
|
21,0 |
0,770 |
||
|
22,0 |
0,775 |
Кривая «a» имеет вид кривой, рассчитанной теоретически. Точка эквивалентности соответствует точке перегиба и находится в середине восходящей ветви кривой (т.э.).
Зависимость ΔE/ΔV от V имеет максимум, соответствующий по оси абсцисс точке между 19,9 и 20,1 мл раствора титранта, что совпадает с точкой эквивалентности на кривой "а". Построение зависимости второй производной потенциала по объему требует вычислений Δ2E/ΔV2, что несложно выполнить, если титрование проводится равными порциями раствора реагента. В таблице 4 в столбце 4 даны результаты таких вычислений на участке близком к точке эквивалентности. Данные показывают, что между объемами 19,9 и 20,1 мл титранта, функция Δ2E/ΔV2 меняет знак, проходя через ноль. Объем титранта, соответствующий этой точке, является эквивалентным.
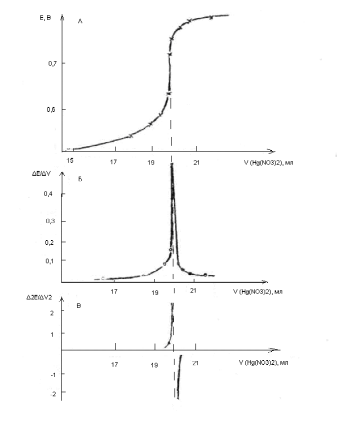
Рисунок 9 – Кривые потенциометрического титрования
Если график зависимости рН (Е) - V(титранта) имеет вид теоретически рассчитанной кривой (рисунок 9 а), то за эквивалентную точку титрования можно взять среднюю точку вертикального участка, определив её визуально. В противном случае поступают следующим образом. По большинству точек каждой части кривой титрования проводят прямые (а, в, с. рисунок 10) до пересечения друг с другом. Находят середину расстояния между точками пересечения (h/2), экстраполируют её на кривую титрования. Объем соответствующий этой точке кривой и будет эквивалентным объемом (Vэ ) титранта в реакции с определяемым веществом.
При построении дифференциальных кривых титрования каждое значение ΔE/ΔV должно соответствовать середине интервала, на котором происходит изменение потенциала на величину ΔE. В зависимости от типа реакции потенциометрическое титрование называется осадительным, комплексометрическим, кислотно-основным, окислительно-восстановительным. Каждый вид титрования имеет свои особенности, обусловленные в основном типом реакции.

Рисунок 10 – Графическое нахождение точки эквивалентности
В качестве индикаторного в осадительном титровании электрода используют металлические электроды первого рода, мембранные, чувствительные к одному из ионов, участвующих в химической реакции. При анализе смесей методом осадительного титрования необходимо подбирать такой реагент, который дает с определяемыми ионами труднорастворимые осадки, отличающиеся величинами произведения растворимости (ПР, Кs0).
При близких значениях ПР возможно осаждение более растворимого вещества во время образования менее растворимого, что приводит к увеличению ошибки анализа. При соизмеримых концентрациях компонентов смеси относительная ошибка может не превышать 1 – 2 %.
Комплексометрическое титрование проводится с использованием металлических (часто ртутных) и мембранных электродов в качестве индикаторных. Ртутный электрод использует при титровании раствором ЭДТА. С помощью ртутного электрода могут быть оттитрованы катионы, образующие комплексные соединения, менее устойчивые, чем НgY2- (Y2- анион ЭДТА). Это такие ионы как Zn2+, Си2+, Мg2+, Са2+, Со2+, Ni 2+ и др.
Потенциометрическое кислотно-основное титрование особенно удобно при анализе смесей кислот или многоосновных кислот (оснований), так как позволяет получить точки эквивалентности каждого компонента. По результатам титрования можно рассчитать приближенные константы диссоциации слабых кислот или оснований.
В окислительно-восстановительном титровании индикаторные электроды используются в основном металлические - из платины, золота, серебра или ртути. Они должны быть инертны по отношению к веществам, участвующим в потенциалопределяющей реакции. Роль металла сводится к переносу электронов. Потенциал электрода в любой момент титрования определяется отношением окисленной и восстановленной форм титруемого вещества или титранта. В точке эквивалентности потенциал зависит от стандартных потенциалов титранта и титруемых веществ [1, 4].
