
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
-
Вопросы для самостоятельной работы
-
Сущность кондуктометрического метода анализа.
-
Удельная и эквивалентная электропроводность.
3 Зависимость удельной и эквивалентной электропроводности от концентрации ионов и их подвижности.
-
Объясните различие зависимости электропроводности от концентрации слабого и сильного электролита.
-
Как изменяется электропроводность растворов с ростом температуры?
-
Сущность метода прямой кондуктометрии.
-
Условия проведения прямых кондуктометрических измерений.
-
Достоинства и недостатки метода прямой кондуктометрии.
-
Реакции, применяемые в методе кондуктометрического титрования, приведите примеры.
-
Причины ошибок в методе кондуктометрического титрования при использовании реакций осаждения и окисления-восстановления.
-
Поведение электролита в поле тока высокой частоты.
-
Характеристики кондуктометрических методов:
а) погрешности;
б) достоинства;
в) недостатки;
г) практическое применение.
2 Потенциометрический метод анализа
-
Общие положения
Потенциометрия основана на измерении разности потенциалов между парой электродов, погружённых в анализируемый раствор. Установка, необходимая для этого, состоит из индикаторного электрода, электрода сравнения и прибора для измерения потенциала. Пара электродов составляет гальванический элемент, один электрод (полуэлемент) которого должен иметь постоянный потенциал, не зависящий от состава раствора. Другой электрод является индикаторным, так как его потенциал зависит от активности анализируемых ионов и измеряется относительно потенциала первого, являющегося электродом сравнения [1, 4].
Для металлического электрода, находящегося в растворе с одноимёнными ионами, потенциал вычисляется по формуле Нернста:
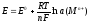 ,
(4)
,
(4)
где E – потенциал электрода, В;
E0 – стандартный электродный потенциал металла, В;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К);
T – абсолютная температура, К;
n
– число электронов, участвующих в
реакции: M
– ne
M
n+
F – число Фарадея, равное 96485 Кл/моль;
a – активность ионов, участвующих в потенциалопределяющей реакции.
Активность
ионов равна произведению коэффициента
активности (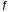 )
на концентрацию (
)
на концентрацию ( ):
):
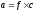 .
Так как в разбавленных растворах
коэффициент активности близок к единице,
то можно использовать вместо активности
концентрацию. Подставив значения
постоянных величин и перейдя к десятичному
логарифму, уравнение Нернста можно
представить в виде:
.
Так как в разбавленных растворах
коэффициент активности близок к единице,
то можно использовать вместо активности
концентрацию. Подставив значения
постоянных величин и перейдя к десятичному
логарифму, уравнение Нернста можно
представить в виде:
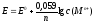
Если в потенциалопределяющей реакции участвуют ионы окисленной и восстановленной форм, то зависимость электродного потенциала от концентрации обеих форм выражается уравнением:
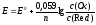 ,
,
где
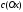 и
и
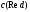 соответственно концентрации окисленной
и восстановленной
соответственно концентрации окисленной
и восстановленной
форм
анализируемого вещества в реакции:
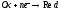 ;
;
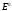 -
стандартный электродный потенциал
данной
-
стандартный электродный потенциал
данной
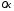 /
/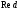 пары.
пары.
Если
стехиометрические коэффициенты не
равны единице и в реакции участвуют
ионы водорода (например: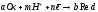 ),
уравнение примет вид:
),
уравнение примет вид:
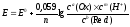
На величину электродного потенциала влияют посторонние ионы, не участвующие в электродной реакции, но взаимодействующие с окислителем и восстановителем. Таким образом, потенциал зависит от природы электролита, температуры, кислотности среды, концентрации ионов, природы (потенциала) электрода сравнения.
