
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
1.2 Методы кондуктометрии
Кондуктометрические методы анализа применимы для количественных определений как в бесцветных прозрачных, так и в окрашенных и мутных системах в присутствии окислителей и восстановителей, в концентрированных и разбавленных растворах, без определения другими методами; кондуктометрический анализ позволяет проводить дифференцированное титрование смесей электролитов.
Можно использовать переменный ток низкой частоты и постоянный ток.
Кондуктометрический анализ проводится несколькими методами.
1.2.1 Прямая кондуктометрия
Метод основан на непосредственном определении концентрации электролита по величине измеренной электропроводности раствора с известным составом.
1.2.2 Хронокондуктометрия
Метод основан на определении количества анализируемого вещества по затраченному на его титрование времени, автоматически регистрируемому на диаграммной ленте при непрерывной или точечной записи кондуктометрических кривых титрования.
1.2.3 Кондуктометрическое титрование
Кондуктометрическое титрование основано на определении количества анализируемого вещества объемным методом. Точку эквивалентности определяют по изменению электропроводности раствора, измеряемой электропроводности раствора, измеряемой в процессе титрования после добавления малых известных порций титранта.
Зависимость электропроводности раствора от объема титранта изображают в виде кривой кондуктометрического титрования, излом на которой соответствует точке эквивалентности.
В кондуктометрическом титровании применимы реакции нейтрализации, осаждения, комплексообразования, окислительно-восстановительные, сопровождающиеся изменением электропроводности растворов в процессе титрования [2].
1.3 Кривые кондуктометрического титрования
Точку эквивалентности или объем титранта, затраченного на взаимодействие с титруемым ионом (веществом) при кондуктометрическом титровании определяют графически как излом на кривой титрования, построенной в координатах «æ-С» или «æ- V». Рассмотрим титрование кривых кондуктометрического титрования при использовании реакций разных типов.
1.3.1 Метод нейтрализации
Пусть титруемым будет раствор соляной кислоты, титрантом-раствор гидроксида натрия. При титровании протекает реакция нейтрализации
HCl + NaOH + H2O = NaCl + 2H2O
H3O+ + Cl- + Na+ +OH- = Na+ + Cl- + 2H2O
H3O+ + OH- = 2H2O (слабый электролит)
До начала титрования раствор соляной кислоты имеет высокую электропроводность, т. к. сильный электролит полностью диссоциирован и концентрация ионов H3O+ высока (подвижность) λ0(H3O+) = 349,8 См·см2/моль, таблица 1).
Таблица 1 - Предельная эквивалентная электропроводность (подвижность) ионов (λ0) в водных растворах при 25 ºС
|
Катион |
λ0 |
Анион |
λ0 |
|
H+ NH4+ K+ Tl+ ½Pb2+ ⅓La3+ ⅓Nd3+ ⅓Fe3+ ½Ba2+ ⅓Al3+ Ag+ ½Sr2+ ½Ca2+ CH3NH3+ ½Cu2+, ½Zn2+ ½Cd2+ ½Ni2+ ½Fe2+ ½Mn2+ ½Mg2+ ½Co2+ Na+ |
349,8 77,8 73,5 73,6 70,0 69,7 69,4 68,0 63,6 63,0 61,9 59,5 59,5 58,7 56,6 54,0 54,0 53,5 53,5 53,1 52,8 50,1 |
OHˉ ¼ [Fe(CN)6]4- ⅓ [Fe(CN)6]3- ½CrO42- ½SO42- Iˉ Brˉ CNˉ Clˉ ½C2O42- NO3ˉ ½WO42- ½CO32- ClO4ˉ CNSˉ HSˉ ½HPO42- Fˉ HCOOˉ HCO3ˉ CHCOOˉ H2PO4ˉ |
198,3 110,5 100,9 85,0 80,0 78,8 78,1 78,0 76,4 74,0 71,5 69,4 69,3 67,4 66,5 65,0 57,0 55,4 54,6 44,5 40,9 36,0 |
В ходе титрования до точки эквивалентности концентрация ионов H3О+ уменьшается, а концентрация ионов ОНˉ не возрастает вследствие образования электролита Н2О. Концентрация хлорид ионов постоянна, концентрация ионов натрия возрастает. Таким образом, до точки эквивалентности на смену высокоподвижным ионам H3О+ приходит эквивалентное количество ионов натрия, подвижность которых невелика (см. таблица 1). Электропроводность титруемого раствора резко уменьшается, на кривой титрования – нисходящая ветвь (кривая 1, рисунок 2) [3].
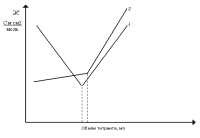
объём титранта, мл
Рисунок 2- Изменение электропроводности при титрование
В точке эквивалентности раствор не содержит ни избытка ионов H3О+, ни избытка ионов ОНˉ. Следовательно, его электропроводность в этот момент минимальна. Точка эквивалентности соответствует точке нейтрализации.
Продолжение титрования после точки эквивалентности соответствует увеличению концентрации ионов Na+ и ОНˉ, концентрации остальных компонентов системы не изменяются, электропроводность титрируемого раствора повышается (восходящая ветвь кривой 1, рисунок 2). Это видно из таких расчетов:
до точки эквивалентности
∆λ0 = λ0 (Na+) - λ0 (H3О+)
∆λ0 =50,1 - 349,8= -299,7 (См·см2/моль)
∆λ0 « 0, электропроводность уменьшается, спад на кривой титрования;
после точки эквивалентности
∆λ0 = λ0 (Na+) + λ0 (ОНˉ)
∆λ0 = 50,1+198,3=248,4 (См·см2/моль)
∆λ0 » 0, электропроводность увеличивается, подъем на кривой титрования.
