
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
2.2.1.3 Мембранные электроды
Как индикаторные эти электроды обладают высокой избирательностью и чувствительностью к катионам и анионам. В зависимости от материала мембраны их разделяют на четыре категории: стеклянные электроды; электроды с жидкими мембранами; электроды с твёрдыми или осадочными мембранами; электроды с газочувствительными мембранами.
Наибольшее практическое применение нашёл стеклянный электрод для измерения pH. Стеклянный электрод занимает промежуточное положение между электродами с жидкими и электродами с твёрдыми мембранами.
Изготавливают стеклянные электроды припаивая к толстостенной стеклянной трубке наконечник (часто в виде шарика) из тонкого pH-чувствительного стекла (рисунок 6). Образующееся пространство внутри шарика заполняют раствором соляной кислоты с концентрацией 0,1 моль/л, насыщенным хлоридом серебра. В раствор погружают серебряную проволоку, которая служит внешним выводом для измерения потенциала.
Таким образом, стеклянный электрод состоит из хлорсеребряного электрода нечувствительного к рН и помещенного в раствор с известной концентрацией ионов водорода Н+ и стеклянной мембраны, отделяющей этот раствор от анализируемого раствора.
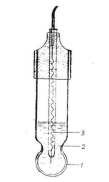
-
- стеклянная мембрана;
2 - буферный раствор или соляная кислота;
3 - хлорсеребряный электрод
Рисунок 6 - Стеклянный электрод
Для измерения потенциала стеклянного электрода его включают в цепь, составляя элемент:
|
Стеклянный электрод |
Исследуемый раствор
|
Электрод сравнения |
Используя в качестве электрода сравнения насыщенный каломельный электрод, электрохимическую цепь можно представить следующим образом.
Внешняя поверхность стеклянного шарика, опущенного в анализируемый раствор, участвует в реакции обмена между однозарядными катионами стекла (Nа+) и протонами раствора, поэтому потенциал мембраны (E1) при установившемся равновесии указанной реакции зависит от активности ионов водорода в исследуемом растворе (a1) на границе 2 -3 (рисунок 7). Активность ионов водорода во внутреннем растворе стеклянного шарика (а2) постоянна, значит потенциал Е2 на границе 1 - 2 (рисунок 7) не изменяется и зависит лишь от способа изготовления стеклянного электрода.
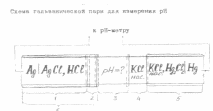
-
- внутренний электрод сравнения - хлорсеребряный;
-
- стеклянная мембрана;
-
- анализируемый раствор;
-
- электролитический (солевой) мостик;
-
- электрод сравнения - насыщенный каломельный электрод;
-
- стеклянный электрод.
Рисунок 7 - Схема гальванической пары для измерения рН
С учетом всего сказанного, потенциал стеклянного электрода можно выразить уравнением:
Е = Е1 – Е2 или
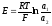 (5)
(5)
При условии постоянства а2 во внутреннем растворе стеклянного шарика, уравнение (12) превращается в:
 ,
(6)
,
(6)
где
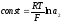 .
.
Примечание - Вывод потенциала стеклянного электрода приведен с сокращением. Подробнее можно прочитать в источнике [4, с.198].
Стеклянные электроды обычно не используют в растворах сильнощелочных (рН >11). Но электроды из специального стекла пригодны для работы в интервале рН 9 - 14.
Точность
определения составляет
 0,05 рН (в области рН 2-10), при более
тщательной работе можно добиться и
более точного измерения. Присутствие
окислителей или восстановителей, газов
не влияет на точность определения.
Измерение рН можно проводить не только
в растворах, но в эмульсиях и пастах.
После работы со щелочными растворами
рекомендуется промывать электрод
разбавленной кислотой и водой. При
измерении в небуферных растворах
равновесие между поверхностным слоем
электрода и раствором устанавливается
медленно. Поэтому необходимо раствор
тщательно перемешивать, а также
подождать несколько минут для достижения
устойчивых показаний.
0,05 рН (в области рН 2-10), при более
тщательной работе можно добиться и
более точного измерения. Присутствие
окислителей или восстановителей, газов
не влияет на точность определения.
Измерение рН можно проводить не только
в растворах, но в эмульсиях и пастах.
После работы со щелочными растворами
рекомендуется промывать электрод
разбавленной кислотой и водой. При
измерении в небуферных растворах
равновесие между поверхностным слоем
электрода и раствором устанавливается
медленно. Поэтому необходимо раствор
тщательно перемешивать, а также
подождать несколько минут для достижения
устойчивых показаний.
Созданы стеклянные электроды для прямого потенциометрического определения концентрации ионов К+, Nа+, NН4+, Rb+, Сs+, Li +, Ag+. Электроды с жидкими мембранами позволяют определять концентрации многозарядных катионов Са2+, Мg2++ Сa2+ и анионов С1-, NO3- , ClO4-. Разработаны электроды с твердыми мембранами, обладавшие селективностью к ионам Вг-, Cd2+, Cl-, Cu2+, CN-, F-, I-, Pb2+, S2-, Ag+, Na+, CNS- [5].
