
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
2.5 Лабораторная работа
Потенциометрическое титрование смеси сильной и слабой кислот
В кислотно-основном потенциометрическом титровании используется в качестве индикаторного стеклянный электрод, потенциал которого зависит от рН раствора и изменяется относительно насыщенного каломельного электрода. В момент эквивалентности наблюдается резкое изменение потенциала (так называемый скачок). При титровании смеси двух кислот с разными константами диссоциации наблюдается два скачка, причем первой титруется более сильная, а затем - более слабая кислота.
1 Задание: определить объемы растворов и массы соляной и уксусной кислот в их смеси методом потенциометрического титрования.
2 Приборы, посуда, реактивы:
-
рН-метр;
-
электроды - стеклянный и насыщенный каломельный;
-
бюретка вместимостью 25 мл;
-
2 пипетки вместимостью 10 мл;
5) стаканчик для титрования вместимостью 50 мл;
6) рабочие титрованные растворы соляной и уксусной кислот и щелочи концентрации 0,1моль/л.
3 Выполнение работы:
-
подготовить прибор к работе в соответствии с инструкцией к прибору или рекомендациями преподавателя;
-
электроды - каломельный и стеклянный промыть проточной дистиллированной водой и последний осушить фильтровальной бумагой. Если необходимо, в каломельный электрод долить насыщенный раствор хлорида калия;
-
в чистый стаканчик для титрования отмерить 10,0мл соляной кислоты, опустить подготовленные электроды и долить дистиллированной воды столько, чтобы шарик электрода был покрыт раствором. Электроды не должны касаться друг друга, стенок и дна стаканчика;
-
бюретку заполнить 0,1 н раствором щелочи;
-
титровать кислоту щелочью, прибавляя её по 1,0 мл и записывая получающиеся значения рН в таблицу с точностью до 0,05. Титрование проводить до резкого изменения рН (до скачка), а затем еще прибавить раствор щелочи, получить 5-6 значений рН, мало отличающихся друг от друга;
6) аналогично оттитровать 10,0 мл уксусной кислоты. Результаты записать и показать преподавателю;
|
V(NaOH), мл
|
0,0 |
1,0 |
2,0 |
и т.д. |
|
|
рН
|
|
|
|
|
|
-
получить контрольный раствор (смесь соляной и уксусной кислот) и оттитровать раствором щелочи;
8) по результатам титрований построить графики зависимости "рН - V(NaOH)". Для контрольного раствора построить также дифференциальную кривую "ΔрН/ΔV- V";
9) найти точки эквивалентности на графиках и вычислить:
а) объемы растворов соляной и уксусной кислот в cмeси, мл;
б) концентрацию NаОН (моль/л) с точностью до 0,0001, используя для этого результаты первого титрования и закон эквивалентов в виде: С(НСl) ∙ V(HCl)=C(NaOH) ∙V(NaOH);
в) массы НСl и СН3СООН (г), учитывая точную концентрацию щелочи.
2.6 Лабораторная работа
Определение малых количеств соды или соляной кислоты
При малых содержаниях в растворах кислоты или соды лучшие результаты по сравнению с классическим титриметрическим методом дает метод потенциометрического титрования с определением точки эквивалентности расчетным способом. При определении, например, соды возможны ошибки из-за СО2 присутствующего в воде и образующего угольную кислоту. При концентрации сильной кислоты более 5 ∙ 10-5 моль/л (pH ≈ 4,3) диссоциация Н2CO3 практически подавлена, что приводит к уменьшению ошибки определения.
Титруют разбавленным раствором соляной кислоты из микробюретки. Проводят холостое титрование, определяя эквивалентный объем НСl, расходуемый на реакцию с растворенным в воде СО2.
1 Приборы, посуда, реактивы:
-
рН-метр;
-
стеклянный и каломельный электроды;
-
микробюретка вместимостью 1-2 мл;
-
2 мерные колбы вместимостью 100 мл;
-
стаканы для титрования вместимостью 150 мл;
-
рабочий титрованный раствор соляной кислоты 0,1моль/л (0,1 н ).
2 Выполнение работы:
1) подготовить прибор к работе в соответствии с инструкцией к прибору;
-
из 0,1н раствора HCl приготовить 100 мл 0,01н раствора НСl;
-
заполнить микробюретку 0,01 н раствором НСl;
-
отмерить мерной колбой 100 мл дистиллированной воды и поместить в стакан для титрования, опустить электроды;
-
титровать воду раствором соляной кислоты до рН = 4,3, записав объем НСl, израсходованный для этого и точное значение рН (pH1 и V1);
-
прилить еще 1 мл раствора НСl, перемешать и записать результаты измерения (pH2 и V2 = V1 + 1);
-
еще раз оттитровать 100 мл воды и записать значения рН и V (HС1); Запись можно вести в виде таблицы.
|
Титруемый раствор |
рН1 |
V1, мл |
рН2 |
V2, мл |
ΔрН |
Vэкв. |
||
|
Вода
|
1 |
|
|
|
|
|
Vэкв.1 |
среднее Vэкв. |
|
2 |
|
|
|
|
|
Vэкв.2 |
||
|
Сода |
|
|
|
|
|
V'экв. |
||
-
в чистую мерную колбу объемом 100 мл получить контрольный раствор соды, долить до метки дистиллированной водой из той же склянки, из которой брали для холостого титрования, перемешать, перелить в стакан для титрования. Титровать как в п.п. 5,6, записать результаты в таблицу;
9) вычисления. По результатам титрований вычислить эквивалентные объемы соляной кислоты Vэкв1 и Vэкв2 пошедшие на 1-е и 2-е титрование воды и средний эквивалентный объем V0экв.

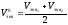 ,
,
а также V/экв. эквивалентный объем, пошедший на титрование раствора соды.
Расчет Vэкв. в каждом титровании проводить по формуле:
 ,
,
где V0 - объем титруемого раствора, равный 100 мл;
ΔрН = рН1 - pH2 - вычисляется для каждого титрования.
Вычислите:
а) количество вещества эквивалентов соды в контрольном растворе:
 ;
;
б) массу соды, мг.
