
- •Электрохимические методы анализа Методические указания
- •Содержание
- •Введение
- •1 Кондуктометрические методы анализа
- •Общие положения
- •1.2 Методы кондуктометрии
- •1.2.1 Прямая кондуктометрия
- •1.2.2 Хронокондуктометрия
- •1.2.3 Кондуктометрическое титрование
- •1.3 Кривые кондуктометрического титрования
- •1.3.1 Метод нейтрализации
- •1.3.2. Метод осаждения
- •1.3.3 Титрование смеси
- •1.4 Высокочастотное титрование
- •1.5 Лабораторная работа
- •Вопросы для самостоятельной работы
- •2 Потенциометрический метод анализа
- •Общие положения
- •2.2 Электроды в потенциометрии
- •2.2.1 Индикаторные электроды
- •2.2.1.1 Электроды первого рода
- •2.2.1.2 Электроды второго рода
- •2.2.1.3 Мембранные электроды
- •2.2.2 Электроды сравнения
- •2.3 Прямая потенциометрия
- •2.4 Потенциометрическое титрование
- •2.5 Лабораторная работа
- •2.6 Лабораторная работа
- •2.7 Лабораторная работа
- •2.8 Определение железа методом потенциометрического титрования
- •Список использованных источников
2.2.2 Электроды сравнения
Поскольку потенциал индикаторного электрода невозможно измерить непосредственно используют систему двух электродов, т.е. гальванический элемент, состоящий из индикаторного электрода и электрода сравнения. Относительно потенциала последнего и измеряют потенциал индикаторного электрода.
Электродом сравнения называют электрод, потенциал которого известен и не зависит от состава исследуемого раствора. Он должен быть прост в изготовлении, сохранять практически постоянный и воспроизводимый потенциал при прохождении небольших токов. Таким требованиям отвечает ряд электродов: хлорсеребряный, каломельный, водородный, хингидронный, меркуриодидный и др.
В
таблице 2 приведены некоторые
характеристики указанных выше электродов
сравнения. Реакция типа
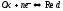 является
потенциалопределяющей.
является
потенциалопределяющей.
Таблица 2 – Характеристики некоторых электродов сравнения
|
Название электрода |
Состав электрода и уравнение потенциалопределяющей реакции |
Формула вычисления потенциала электрода |
|
Каломельный |
Hg, Hg2Cl2 (нас.) │КСl Hg2Cl2 +2ē ↔2Hg +2Cl- |
E = E0 – 0,059 lgC(Cl-) |
|
Хлорсеребряный
|
Ag, AgCl │KCl (NaCl) AgCl +ē ↔ Ag + Cl- |
E = E0 – 0,059 lgC(Cl-) |
|
Меркуриодидный |
Hg, Hg2I2 │КСl Hg2I2 +2ē ↔2Hg +2I- |
E = E0 – 0,059 lgC(I-) |
|
Сульфатно-ртутный |
Hg, Hg2SO4 │H2SO4 Hg2SO4–2ē ↔2Hg + SO42- |
E = E0 – 0,059/2 lgC(SO42-) |
|
Хингидронный |
C6H4O2, C6H4(OH)2, Pt│H+ C6H4O2 + 2ē +2H+ ↔ C6H4(OH)2 |
E = E0 – 0,059 рН |
|
водородный |
Pt, H2 │ H2SO4 2H+ + 2 ē ↔ H2 |
E = – 0,059 рН |
Выбор электрода сравнения определяется рядом факторов, но основным является измеряемый потенциал полуреакции, протекающей на индикаторном электроде.
Наиболее часто используется каломельный электрод, состоящий из ртути, хлорида ртути (+1), т.е. каломели и раствора хлорида калия заданной концентрации. Электрод образует систему аналогичную хлорсеребряному. В зависимости от концентрации раствора хлорида калия каломельные электроды изготовляют трех типов (таблица 3).
Таблица 3 – Характеристики каломельных электродов
|
Название электрода |
С (КСl), моль/л |
Формула вычисления потенциала |
Значение Е0, В |
|
насыщенный |
нас. |
Е = Е0 – 0,00076 ∙ (Т-298) |
0,247 |
|
нормальный |
1 |
Е = Е0 – 0,00024 ∙ (Т-298) |
0,284 |
|
децинормальный |
0,1 |
Е = Е0 – 0,00007 ∙ (Т-298) |
0,337 |
Насыщенный каломельный электрод используется чаще других химиками-аналитиками, так как он прост в изготовлении и доступен любой лаборатории.
Электрод с С(KCl) = 0,1 моль/л более предпочтителен при проведении исследовательских работ, где требуются более точные измерения. Температурный коэффициент у него самый низкий (0,00007 В/град).
