
- •Вопрос 1)Виды анализа: элементный, молекулярный, фазовый, функциональный. Характеристики и сущности каждого из них.
- •Вопрос 2. Классификация физико – химических (инструментальных) методов анализа.
- •Вопрос 3.Понятие о пробоотборе и пробоподготовке.
- •Вопрос 4.? Оптические (спектральные) методы анализа: теоретические основы методов, виды взаимодействия электромагнитного излучения с веществом (рефракция, рассеивание, поглощение и т.Д)
- •Вопрос 5.Правило частот Бора: понятие оптического спектра, закон Бугера – Ламберта – Бера.
- •Вопрос 6. Виды электронов в молекуле. Причины возникновения электронных спектров молекул.
- •Вопрос 7.? Связь пропускания и оптической плотности. Закон светопоглощения.
- •Вопрос 8. Люминесцентный анализ. Теоретические основы метода. Виды люминесценции.
- •Вопрос 9. Рефрактометрия. Теоретические основы метода.
- •Вопрос 10. Поляриметрия. Основы метода. Поляриметры и сахариметры.
- •Методы основаны на измерении:
- •Поляриметр.
- •Сахариметр.
- •Вопрос 11. Фотоколометрия. Закон светопоглощения.
- •Закон светопоглощения.
- •Вопрос 12. Количественный анализ в спектрофотометрии. Градуировка.
- •Градуировка.
- •Вопрос 13.
- •Вопрос 14. Принципы поглощения инфракрасного излучения.
- •Вопрос 15. Принципы инфракрасной спектроскопии- схема спектрофотометра, источники излучения, конструкционные материалы кювет.
- •Источники излучения.
- •Конструкционные материалы кювет.
- •Вопрос16. Характеристические частоты и корреляционные таблицы. Виды колебаний в молекуле.
- •Кореляционные таблицы.
- •Виды колебаний в молекуле.
- •17. Качественный и количественный анализ в ик-спектроскопии.
- •18. Классификация электрохимических методов.
- •19.Потенциометрия. Ион – селективные электроды. Потенциометия, рН метры. Определение активной и общей кислотности.
- •20. Полярография. Полярографическая волна, потенциал полуволны. Качественный и количественный анализ.
- •21. Амперометрическая титрование. Определение редуцирующих сахаров.
- •22. Хроматографические методы анализа. Классификация хроматографических методов основные понятия: сорбент, элюент.
- •23. Принципы хроматографии – явления на границе фаз.
- •24. Метод жидкостной колоночной хроматографии.
- •25. Сущность и основные количественные параметры в методе тонкослойной хроматографии.
- •27. Принципиальная схема газо - хроматографической установки.
- •28. Детекторы газовой и жидкостной хроматографии.
- •29. Масс-спектрометрия: теоретические основы метода, способы ионизации и последующей фрагментации молекул; разделение ионов по массе в магнитном поле.
- •30. Устройство и назначение основных блоков масс-спектрометра.
- •31. Закономерности фрагментации алифатических и ароматических соединений; нормальный масс спектр.
- •32. Жидкостная масс спектроскопия; применение масс спектрометрии для идентификации в-в.
Вопрос 6. Виды электронов в молекуле. Причины возникновения электронных спектров молекул.
Виды электронов в молекуле:
1)электроны внутренних слоев прочно связаны с атомным ядром. Принадлежат атому и в образовании химической связи не участвуют – это атомные электроны.
2)Электроны внешних энергетических уровней принимают участие в образовании химических связей – это молекулярные электроны.
3)электроны внешних оболочек атома не принимают участие в образовании химических связей – это спаренные электроны.(не поделены)
Причины возникновения электронных спектров молекул.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Хромофор – структурная группа в органическом соединении, которая
обуславливает избирательное поглощение света в электронном спектре. Обычно
это группы,
для которых характерны переходы
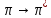 и n
и n : C=C, C≡C, C=O,
: C=C, C≡C, C=O,
N=N, N=O, NO2, ароматические системы и т.д.
Ауксохром – насыщенная группа в органическом соединении,
присоединение которой к хромофору изменяет положение и интенсивность
полосы поглощения последнего в спектре. Обычно это группы: –Alk, –NR2, –OR,
-Hlg
Классификация молекулярных орбиталей.
Различают связывающие,разрыхляющие (антисвязывающие) и несвязывающие МО.
Если при удалении электрона с данной МО энергия молекулы повышается, т.е. система становится
менее прочной, то орбиталь называется связывающей, если энергия понижается
– разрыхляющей, а если практически не меняется – несвязывающей. Таким
образом, энергии МО увеличиваются в следующем порядке: связывающие,
несвязывающие и разрыхляющие .Связывающие МО образуются при
перекрывании различных атомных орбиталей (АО) в фазе (одинаковые знаки
волновых функций), а разрыхляющие – в противофазе (различные знаки
волновых функций)
Переходы:


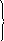
Разрыхляющие
МО

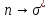
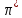



n
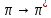 Несвязывающие
МО(неподеленные электрон.пары)
Несвязывающие
МО(неподеленные электрон.пары)


 Связывающие
молекуляр.орбитали
Связывающие
молекуляр.орбитали
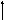


Электронные переходы σ→σ*имеют наибольшую энергию и характерны для всех классов органических соединений. Однако как единственный тип электронного перехода встречаются только в насыщенных углеводородах (алканах и циклоалканах). Например, метан и этан имеют сплошной спектр поглощения с максимумами при 93 и 85 нм соответственно. Для всех органических соединений, за исключением циклопропана (λмакс. 190 нм) и его производных, σ→σ* переходы находятся в области вакуумного УФ. Они обладают средней интенсивностью (lg ~ 2 – 3). Вследствие технических трудностей регистрации электронных спектров в области вакуумного УФ σ→σ* переходы для анализа не используются и имеют наименьшую характеристичность по сравнению с остальными видами электронных переходов.
Электронные переходы n→σ*имеют меньшую энергию, чем σ→σ* переходы. Большинство n→σ* переходов попадают в дальнюю УФ область. Длины волн максимумов полос поглощения n→σ* переходов находятся в диапазоне 150–250 нм с интенсивностью поглощения, характеризующейся величиной (lg ~ 2 – 4). Как правило, полосы n→σ* переходов довольно широкие и размытые. Переходы n→σ* характерны для органических молекул, содержащих гетероатомы с неподеленной электронной парой, например, спиртов, тиолов, галогеналканов, простых эфиров, аминов, альдегидов, кетонов, сложных эфиров и т.д. В табл. 1 приведен ряд примеров соединений, в которых наблюдаются n→σ* переходы
Электронные переходы π→π*можно наблюдать в спектрах всех ненасыщенных органических соединений: алкенов, алкинов, диенов, аренов, альдегидов, кетонов, фенолов, азо- и нитропроизводных, и т.д. Переходы данного типа обладают высокой интенсивностью (lg~ 3 – 4). Примеры простых хромофоров, (Хромофор – структурная группа в органическом соединении, которая
обуславливает избирательное поглощение света в электронном спектре. Обычно
это группы,
для которых характерны переходы
 и n
и n : C=C, C≡C, C=O,
: C=C, C≡C, C=O,
N=N, N=O, NO2, ароматические системы и т.д.)
в которых поглощение происходит за счет π→π* электронных переходов, а характеристики поглощения представителей разных классов органических соединений.
В несопряжённых системах переходы π→π* близки по энергии сn→σ* переходами, поэтому они также, в основном, регистрируются в вакуумной УФ области.
Существенно большее значение для электронной спектроскопии имеют π→π* электронные переходы в молекулах с сопряжёнными кратными связями, которые могут попадать даже в видимую и ближнюю инфракрасную области. Переходы π→π* в сопряжённых системах иногда имеют тонкую колебательную структуру (неполярный растворитель или газовая фаза). Следует отметить, что в сопряженных системах полосы поглощения обладают гораздо большей
интенсивностью (К-полосы, lgε > 4), чем в несопряженных, причем коэффициент экстинкции возрастает с увеличением цепи сопряжения.
Электронные переходы n→π*наблюдаются в спектрах соединений, в структуре которых несущий неподелённую электронную пару гетероатом соединён кратной π-связью (обычно двойной) с соседним атомом. Типичные изолированные (несопряжённые) хромофоры, для которых характерны n→π*переходы.
Переходы n→π* имеют наименьшую энергию из всех видов электронных переходов (см. рис. 1). Они являются малоинтенсивными lgε < 2. Полосы поглощения n→π* переходов обычно находятся в области, не закрытой полосами остальных переходов (λмакс. > 250 нм, это самые длинноволновые переходы), что позволяет их наблюдать, несмотря на малую интенсивность.
Переходы n→π* типа, наряду с π→π* переходами в сопряжённых системах, составляют наибольшую часть всех практически значимых переходов в электронной спектроскопии.
