
- •Лабораторная работа 1 Основные классы неорганических соединений
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 2 Определение молярной массы эквивалентов цинка
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов Таблица 2.1
- •Давление насыщенного водяного пара при различных температурах
- •Примеры решения задач
- •Лабораторная работа 3 Определение теплоты реакции нейтрализации
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •После подстановки справочных данных из табл.Iполучаем:
- •Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
- •Подставляем в формулу справочные данные из табл.Iи получаем:
- •Используя справочные данные табл.Iполучаем:
- •Решение. ВычисляемDh0х.Р.ИDs0х.Р.:
- •Энергию Гиббса при соответствующих температурах находим из соотношения
- •При сгорании 1 л с2н4 (н.У.) выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).
- •№ 3.3. А) Сожжены с образованиемH2o(г) равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ:5,2).
- •Лабораторная работа 4 Скорость химической реакции
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Зависимость скорости реакции от температуры
- •Примеры решения задач
- •Лабораторная работа 5 Катализ
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 6 Химическое равновесие
- •Теоретическое введение
- •Выполнение работы
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние температуры на химическое равновесие
- •Примеры решения задач
- •Лабораторная работа 7 Определение концентрации раствора кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •4,37 Моль/кг
- •Лабораторная работа 8 Реакции в растворах электролитов
- •Теоретическое введение
- •Опыт 1. Сравнение химической активности кислот
- •Опыт 2. Реакции, идущие с образованием осадка
- •Опыт 3. Реакции, идущие с образованием слабого электролита
- •Опыт 4. Реакции, идущие с образованием газа
- •Опыт 5. Амфотерные электролиты
- •Примеры решения задач
- •Лабораторная работа 9 Гидролиз солей
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Примеры решения задач
- •Лабораторная работа 10 Коллоидные растворы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 11 Окислительно-восстановительные реакции
- •Теоретическое введение
- •2O−2 – 4ē → o20 ½3 − окисление
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция (групповой)
- •Примеры решения задач
- •Лабораторная работа 12 Коррозия металлов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Примеры решения задач Электродные потенциалы. Гальванические элементы. Коррозия металлов
- •Стандартные электродные потенциалы (jo) при 25oС и электродные реакции для некоторых металлов
- •Для первого электрода:
- •Для второго электрода:
- •Лабораторная работа 13 Электролиз
- •Теоретическое введение
- •Выполнение работы Опыт 1. Электролиз раствора иодида калия
- •Опыт 2. Электролиз раствора сульфата натрия
- •Опыт 3. Электролиз раствора сульфата меди
- •Опыт 4. Электролиз с растворимым анодом
- •Примеры решения задач
- •Лабораторная работа 14 Химические свойства металлов
- •Теоретическое введение
- •Выполнение работы
- •Опыт 4. Действие щелочи на металлы
- •Лабораторная работа 15 Комплексные соединения
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 16
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 17 Жёсткость воды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 18 Алюминий, олово, свинец
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 19 Металлы подгрупп меди и цинка
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 20 Хром
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 21 Марганец
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 22 Железо, кобальт, никель
- •Теоретическое введение
- •Выполнение работы
- •Опыт 3. Получение и свойства гидроксида никеля (II)
- •Опыт 6. Получение комплексных соединений кобальта
- •Опыт 7. Получение комплексных соединений никеля
- •Лабораторная работа 23 Галогены
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 24 Кислород. Пероксид водорода
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 25 Сера
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 26 Азот
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 27 Углерод. Кремний
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 28 Углеводороды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 29 Спирты, альдегиды, кетоны
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 30 Органические кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 31 Распознавание высокомолекуляных материалов
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 32 Получение фенолоформальдегидных смол
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 33 Качественный анализ металлов
- •Выполнение работы
- •Лабораторная работа 34 Качественные реакции на анионы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 35 Количественное определение железа в растворе его соли
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Библиографический список
- •Приложение а
- •Требования к оформлению отчета по лабораторной работе
- •Растворимость солей и оснований в воде
- •Периодическая система
- •Элементов д.И. Менделеева Таблица 3
Лабораторная работа 35 Количественное определение железа в растворе его соли
Цель работы: познакомиться с одним из методов количественного анализа − химическим анализом.
Задание: определить количественное содержание железа в исследуемом растворе сульфата железа титриметрическим методом. Выполнить требования к результатам опыта, оформить отчет, решить задачу.
Теоретическое введение
Количественный анализ − совокупность методов, с помощью которых определяют содержание (массы, концентрации и т.п.) или количественные соотношения компонентов в анализируемом образце.
Все методы количественного анализа делятся на две большие группы: инструментальные и химические, в основе которых лежит химическая реакция. К химическим методам относятся гравиметрические и титриметрические методы анализа.
Гравиметрический анализ состоит в определении массы и содержания какого-либо элемента, иона или химического соединения в анализируемом объекте. Определяемый компонент осаждают из раствора в виде какого-либо малорастворимого соединения, которое затем отделяют от раствора.
Титриметрические методы анализа основаны на измерении объема раствора реагента с точно известной концентрацией, затраченного на взаимодействие с определенным объемом анализируемого вещества. Раствор, концентрация которого (обычно титр раствора) точно известна, называется титрованным. Титром называется масса вещества, содержащегося в 1мл (см3) титрованного раствора. Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента.
Расчет производится по уравнению закона эквивалентов C1V1 = C2V2 , где C1 и V1 − объем и концентрация титрованного раствора, C2 и V2 − объем и концентрация анализируемого раствора.
Одной из разновидностей титриметрического анализа является окислительно-восстановительное титрование, суть которого заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя.
Определение железа и его соединений основано на титровании раствора, содержащего ионы Fe2+(восстановителя), раствором перманганата калия (окислителя) известной концентрации. Реакция протекает по уравнению:
2KMnO4+ 10FeSO4+ 8H2SO4→ 2MnSO4+K2SO4+ 5Fe2(SO4)3+ 8H2O
Выполнение работы
В мерную колбу вместимостью 100 мл налить точно отмеренный объем исследуемого раствора сульфата железа (II). Добавить в колбу 10 мл 2 н раствора серной кислоты и до половины колбы дистиллированной воды. Перемешать раствор круговыми движениями колбы, долить воды до метки и еще раз тщательно перемешать приготовленный рабочий раствор.
Наполнить бюретку 0,05 н раствором перманганата калия KMnO4 и установить уровень раствора на нулевое деление бюретки.
Провести ориентировочное титрование рабочего раствора. Для этого взять пипеткой 10 мл раствора из мерной колбы и перенести в коническую колбу для титрования. Затем прибавлять к нему небольшими порциями раствор перманганата калия из бюретки до неисчезающего в течение 30 секунд обесцвечивания титруемого раствора. Первые капли раствора перманганата калия обесцвечиваются довольно медленно. Как только образуется в растворе немного ионов Mn2+, являющихся катализатором для данной реакции, дальнейшее обесцвечивание перманганата до конца титрования происходит почти мгновенно. Провести 3 точных титрования. Результаты не должны отличаться более, чем на 0,05 мл. Взять среднее значение для проведения расчетов.
Данные опыта занести в таблицу 35.1:
Данные опыта и результаты расчетов Таблица 35.1
|
№ п/п |
V(FeSO4) Объем соли железа |
V(KMnO4) Объем перманганата калия |
Vср (KMnO4) Средний объем перманганата калия |
|
1 |
|
|
|
|
2 |
|
| |
|
3 |
|
|
Требования к результатам опыта:
1. Рассчитать молярную концентрацию эквивалентов раствора соли железа по закону эквивалентов:
Сэк (FeSO4) · V (FeSO4) = Сэк (KMnO4) · V (KMnO4) ,
откуда
![]()
![]()
![]()
![]()
![]()
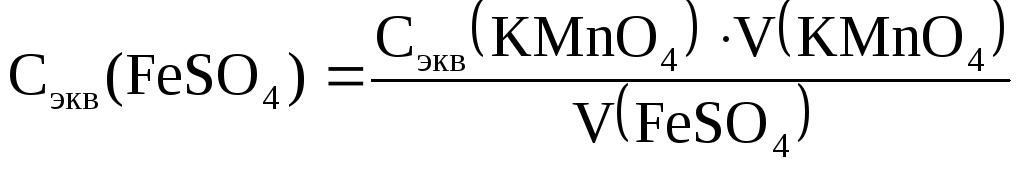
![]()
где Сэк (FeSO4) иCэк (KMnO4) – молярные концентрации эквивалентов растворов;V(FeSO4) иV(KMnO4) − объемы реагирующих растворов.
2. Рассчитать, какому количеству металлического железа соответствует содержание FeSO4в объеме исследуемого раствора по формуле:
m (Fe) = Mэк (Fe) · Сэк (FeSO4),
где Mэк(Fe) – молярная масса эквивалентов железа.
3. Рассчитать титр раствора FeSO4 по формуле
![]() ,
г/мл
,
г/мл
где Мэк (FeSO4) – молярная масса эквивалентов FeSO4; Сэк (FeSO4) – молярная концентрация эквивалентов FeSO4.
