
- •Лабораторная работа 1 Основные классы неорганических соединений
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 2 Определение молярной массы эквивалентов цинка
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов Таблица 2.1
- •Давление насыщенного водяного пара при различных температурах
- •Примеры решения задач
- •Лабораторная работа 3 Определение теплоты реакции нейтрализации
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •После подстановки справочных данных из табл.Iполучаем:
- •Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
- •Подставляем в формулу справочные данные из табл.Iи получаем:
- •Используя справочные данные табл.Iполучаем:
- •Решение. ВычисляемDh0х.Р.ИDs0х.Р.:
- •Энергию Гиббса при соответствующих температурах находим из соотношения
- •При сгорании 1 л с2н4 (н.У.) выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).
- •№ 3.3. А) Сожжены с образованиемH2o(г) равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ:5,2).
- •Лабораторная работа 4 Скорость химической реакции
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Зависимость скорости реакции от температуры
- •Примеры решения задач
- •Лабораторная работа 5 Катализ
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 6 Химическое равновесие
- •Теоретическое введение
- •Выполнение работы
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние температуры на химическое равновесие
- •Примеры решения задач
- •Лабораторная работа 7 Определение концентрации раствора кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •4,37 Моль/кг
- •Лабораторная работа 8 Реакции в растворах электролитов
- •Теоретическое введение
- •Опыт 1. Сравнение химической активности кислот
- •Опыт 2. Реакции, идущие с образованием осадка
- •Опыт 3. Реакции, идущие с образованием слабого электролита
- •Опыт 4. Реакции, идущие с образованием газа
- •Опыт 5. Амфотерные электролиты
- •Примеры решения задач
- •Лабораторная работа 9 Гидролиз солей
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Примеры решения задач
- •Лабораторная работа 10 Коллоидные растворы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 11 Окислительно-восстановительные реакции
- •Теоретическое введение
- •2O−2 – 4ē → o20 ½3 − окисление
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция (групповой)
- •Примеры решения задач
- •Лабораторная работа 12 Коррозия металлов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Примеры решения задач Электродные потенциалы. Гальванические элементы. Коррозия металлов
- •Стандартные электродные потенциалы (jo) при 25oС и электродные реакции для некоторых металлов
- •Для первого электрода:
- •Для второго электрода:
- •Лабораторная работа 13 Электролиз
- •Теоретическое введение
- •Выполнение работы Опыт 1. Электролиз раствора иодида калия
- •Опыт 2. Электролиз раствора сульфата натрия
- •Опыт 3. Электролиз раствора сульфата меди
- •Опыт 4. Электролиз с растворимым анодом
- •Примеры решения задач
- •Лабораторная работа 14 Химические свойства металлов
- •Теоретическое введение
- •Выполнение работы
- •Опыт 4. Действие щелочи на металлы
- •Лабораторная работа 15 Комплексные соединения
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 16
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 17 Жёсткость воды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 18 Алюминий, олово, свинец
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 19 Металлы подгрупп меди и цинка
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 20 Хром
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 21 Марганец
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 22 Железо, кобальт, никель
- •Теоретическое введение
- •Выполнение работы
- •Опыт 3. Получение и свойства гидроксида никеля (II)
- •Опыт 6. Получение комплексных соединений кобальта
- •Опыт 7. Получение комплексных соединений никеля
- •Лабораторная работа 23 Галогены
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 24 Кислород. Пероксид водорода
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 25 Сера
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 26 Азот
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 27 Углерод. Кремний
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 28 Углеводороды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 29 Спирты, альдегиды, кетоны
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 30 Органические кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 31 Распознавание высокомолекуляных материалов
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 32 Получение фенолоформальдегидных смол
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 33 Качественный анализ металлов
- •Выполнение работы
- •Лабораторная работа 34 Качественные реакции на анионы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Лабораторная работа 35 Количественное определение железа в растворе его соли
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Библиографический список
- •Приложение а
- •Требования к оформлению отчета по лабораторной работе
- •Растворимость солей и оснований в воде
- •Периодическая система
- •Элементов д.И. Менделеева Таблица 3
Лабораторная работа 28 Углеводороды
Цель работы: изучить понятия «алканы», «алкены», «алкины».
Задание: провести опыты по получению этилена и ацетилена, изучить свойства этилена, ацетилена и бензола. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Углеводороды являются простейшими по составу органическими соединениями, т. к. они состоят только из углерода и водорода. При замещении в молекулах углеводородов атомов водорода на атомы или группы атомов (радикалы) других элементов получаются другие классы органических соединений (производные углеводородов).
По характеру связи между углеродными атомами различают углеводороды с простыми связями, в которых все атомы углерода связаны одной ковалентной связью, и углеводороды с кратными (двойными или тройными) связями. В углеводородах с двойными связями два углеродных атома связаны между собой двумя ковалентными связями. Простейшим из этих углеводородов является этилен СН2=СН2.
Углеводороды с тройной связью содержат атомы углерода, связанные между собой тремя ковалентными связями, например ацетилен Н−С≡С–Н.
Углеводороды с простой связью характеризуются малой химической активностью. Они не вступают в реакции присоединения и, вследствие этого, получили название предельных (насыщенных) углеводородов. Углеводороды с кратными связями способны за счет разрыва второй и третьей связи присоединять водород, галогены и т. д. Например:
CН2=CН2 + Br2 → CН2Br−CН2Br.
этилен дибромэтан
Поэтому они названы непредельными (ненасыщенными) углеводородами.
К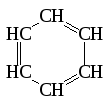 ратные
связи могут содержаться и в молекулах
циклических углеводородов. В тех случаях,
когда цикл состоит из шести углеродных
атомов, связанных между собой чередующимися
простыми и двойными связями, углеводороды
называются ароматическими. Простейшим
из них является бензол.
ратные
связи могут содержаться и в молекулах
циклических углеводородов. В тех случаях,
когда цикл состоит из шести углеродных
атомов, связанных между собой чередующимися
простыми и двойными связями, углеводороды
называются ароматическими. Простейшим
из них является бензол.
Несмотря на то, что в молекулах ароматических углеводородов имеются три двойные связи, они по своим химическим свойствам ближе к предельным углеводородам, т.е. способны, главным образом, к реакциям замещения.
Выполнение работы
Опыт 1. Получение этилена и его свойства
В пробирку налить 1-1,5 мл этилового спирта и 5 мл концентрированной серной кислоты (ρ=1,84 г/мл). Укрепить пробирку в зажиме штатива, закрыть ее пробкой с газоотводной трубкой, конец которой поместить в пробирку с разбавленной бромной водой, и нагреть. Наблюдать обесцвечивание бромной воды. Когда обесцвечивание закончится, переместить конец газоотводной трубки в пробирку со слабо окрашенным раствором КMnO4. Когда раствор обесцветится, вынуть из него трубку и после этого прекратить нагревание.
Требования к результатам опыта:
1. Написать уравнение реакции получения этилена.
2. Закончить уравнения реакций: CН2=CН2 + Br2 →
CН2=CН2 + [O] + H2O →
3. По результатам опыта сделать вывод о химических свойствах этилена.
Опыт 2. Ацетилен и его свойства
В небольшую колбу налить на ⅔ ее объема воды, закрепить ее в штативе, бросить в нее небольшой кусочек карбида кальция СаС2, быстро закрыть отверстие пробирки пробкой с газоотводной трубкой и, опустив конец последней в пробирку с бромной водой, пропустить через бромную воду ток ацетилена. Что происходит с окраской раствора? Пропустить ток ацетилена через подкисленный раствор перманганата калия. Как изменилась окраска раствора?
Требования к результатам опыта:
1. Написать уравнение реакции получения ацетилена при взаимодействиии карбида кальция с водой.
2. Записать уравнения реакций между ацетиленом и бромом (промежуточным продуктом является дибромэтилен, конечным − тетрабромэтан).
3. Закончить уравнение реакции C2H2 + KMnO4 + H2SO4 →, принимая, что конечными продуктами реакции являются муравьиная кислота НСООН, диоксид углерода, сульфат марганца (II), сульфат калия и вода.
4. По результатам опыта сделать вывод о химических свойствах ацетилена.
Опыт 3. Свойства бензола
В две пробирки налить 1-2 мл бензола, в одну пробирку прилить 1-2 мл бромной воды, в другую пробирку – 1-2 мл раствора перманганата калия, подкисленного серной кислотой, пробирки встряхнуть.
Требования к результатам опыта:
1. Записать наблюдения. Объяснить, почему растворы бромной воды и перманганата калия не обесцвечиваются при добавлении бензола.
2. Охарактеризовать способность бензола к реакциям присоединения и окисления, присущим непредельным углеводородам.
