
- •Содержание
- •Тема: Гравиметрический анализ
- •Тема: Кислотно–основное титрование
- •Тема: Методы окислительно-восстановительного титрования. Иодометрия
- •Тема: Броматометрическое титрование
- •Тема: Нитритометрия
- •Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
- •Тема: Комплексонометрия.
- •Электив « методы аналитической химии»
- •Методические рекомендации
- •Ход определения
- •Ход определения
- •Методические рекомендации
- •К учебно-исследовательской работе № 5
- •« Определение содержания кальция и магния в
- •Растворе при их совместном присутствии»
- •Ход определения
- •Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
- •Методические рекомендации
- •Приложение
Электив « методы аналитической химии»
Методические рекомендации
к учебно-исследовательской работе №1
«Определение массы железа (II) в растворе»
Одним из наиболее надежных и точных методов определения железа в растворе является дихроматометрия. В кислой среде дихромат является сильным окислителем, при этом он восстанавливается до ионов Cr3+.


Раствор K2Cr2O7, как правило, готовиться по точной навеске и не требует стандартизации. Раствор очень устойчив.

Индикаторами могут являться дифениламин, дифенилбензидин, фенилантраниловая кислота, ферроин и др.
Прямое титрование
растворами K2Cr2O7
применяется для быстро протекающих
реакций при титровании восстановителей
( ,
,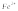 ,
,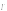 ,
, ,
аскорбиновая кислота, метанол).
,
аскорбиновая кислота, метанол).
Например, при определении метанола протекает следующая реакция:

Восстановители,
медленно реагирующие с K2Cr2O7,
анализируются обратным титрованием.
Избыток K2Cr2O7
оттитровывают раствором Fe2+
(как правило, используют соль Мора). Этот
вариант метода широко применяется для
определения т.н. бихроматной окисляемости
воды (химическое потребление кислорода).
Возможно определение окислителей
(например,
 -
ионов) по схеме:
-
ионов) по схеме:

точный
избыток

(то есть применяется метод обратного титрования)
Существует и осадительный вариант метода, например, определение ионов Ba2+, Pb2+, Ag+ и др.
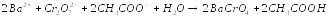
точный
избыток
Избыток дихромата определяют иодометрически.
Титрование железа (II) основано на реакции:

В процессе титрования
повышается концентрация ионов железа
(II)
и окислительно-восстановительный
потенциал системы
 возрастает, что приводит к преждевременному
окислению индикатора дифениламина.
Если прибавить к титруемому раствору
фосфорную кислоту, то окраска индикатора
резко изменяется в точке эквивалентности.
Фосфорная кислота понижает
окислительно-восстановительный потенциал
системы
возрастает, что приводит к преждевременному
окислению индикатора дифениламина.
Если прибавить к титруемому раствору
фосфорную кислоту, то окраска индикатора
резко изменяется в точке эквивалентности.
Фосфорная кислота понижает
окислительно-восстановительный потенциал
системы ,
образуя устойчивый комплекс с ионами
железа (III)
,
образуя устойчивый комплекс с ионами
железа (III)
 .
.
Ход определения
Полученный раствор
в мерной колбе Vk
= 100 мл доводят водой до метки и тщательно
перемешивают. В три колбы для титрования
отбирают мерной пипеткой (Vп.
= 10 мл) аликвотные пробы раствора задачи,
добавляют мерными пробирками 10 мл H2SO4
(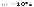 )
и 2 мл конц. Н3РО4.
Вносят 3 капли индикатора – дифениламина.
)
и 2 мл конц. Н3РО4.
Вносят 3 капли индикатора – дифениламина.
Бюретку промывают
стандартным раствором K2Cr2O7
 и заполняют, не забыв удалить воздух из
носика. Титруют до появления синей
окраски раствора. Рассчитывают средний
объём (исходя из трех титрований) и массу
железа по формуле:
и заполняют, не забыв удалить воздух из
носика. Титруют до появления синей
окраски раствора. Рассчитывают средний
объём (исходя из трех титрований) и массу
железа по формуле:

(до четвертой цифры после запятой)
Работа оценивается по величине относительной ошибки.
Методические рекомендации
к учебно-исследовательской работе №2
«Стандартизация ~0,1 н. раствора KMnO4 по щавелевой
кислоте методом отдельных навесок»
Раствор KMnO4
применяют как окислитель. В сильнокислой
среде ион
 восстанавливается до
восстанавливается до :
:
 ,
,

Раствор перманганата
калия изменяет свою концентрацию в
присутствии самых различных восстановителей,
при нагревании, на свету. Поэтому раствор
KMnO4
нельзя приготовить по точной навеске.
Стандартизацию этого раствора проводят
по щавелевой кислоте
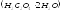 или её соли – безводному оксалату натрия
или её соли – безводному оксалату натрия ,
по оксиду мышьяка
,
по оксиду мышьяка ,
металлическому железу, иодиду калия и
т.д. Установку точной концентрации
раствора перманганата калия по щавелевой
кислоте проводят в сернокислой среде
в соответствии с уравнением:
,
металлическому железу, иодиду калия и
т.д. Установку точной концентрации
раствора перманганата калия по щавелевой
кислоте проводят в сернокислой среде
в соответствии с уравнением:

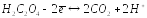
При комнатной
температуре эта реакция идет медленно,
она ускоряется по мере накопления
катионов
 (катализатора). Поэтому исходный раствор
щавелевой кислоты нагревают до температуры
~60÷80ºС (но не кипятят, что может привести
к разложению кислоты). В начале титрования
горячий раствор обесцвечивается
медленно, при достижении определённой
концентрации катионов
(катализатора). Поэтому исходный раствор
щавелевой кислоты нагревают до температуры
~60÷80ºС (но не кипятят, что может привести
к разложению кислоты). В начале титрования
горячий раствор обесцвечивается
медленно, при достижении определённой
концентрации катионов - быстро.
- быстро.
Индикатором этой реакции служит сам титрант KMnO4, при малейшем избытке которого титруемый раствор окрашивается в розовый цвет.
Реактивы: ~0,1 н. раствор KMnO4, Н2С2О4·2Н2О –
кристаллическая, раствор H2SO4 (10%ный).
