
- •Содержание
- •Тема: Гравиметрический анализ
- •Тема: Кислотно–основное титрование
- •Тема: Методы окислительно-восстановительного титрования. Иодометрия
- •Тема: Броматометрическое титрование
- •Тема: Нитритометрия
- •Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
- •Тема: Комплексонометрия.
- •Электив « методы аналитической химии»
- •Методические рекомендации
- •Ход определения
- •Ход определения
- •Методические рекомендации
- •К учебно-исследовательской работе № 5
- •« Определение содержания кальция и магния в
- •Растворе при их совместном присутствии»
- •Ход определения
- •Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
- •Методические рекомендации
- •Приложение
Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
Цель изучения данной темы:
Освоить практические методики определения галогенид – ионов в растворе аргентометрическим и тиоцианатометрическим титрованием.
Научиться решать задачи, связанные с методами осадительного титрования.
Практическая значимость.
Методы осадительного титрования, в частности, аргентометрия и тиоцианатометрия широко используются для анализа ряда лекарственных веществ, содержащих в молекуле атомы галогенов (CI, Br, I). Посредством этих методов проводят количественные определения неорганических лекарственных веществ - галогенидов щелочных металлов (NaBr, KBr, KI), четвертичных аммониевых оснований, гидрогалогенидов органических оснований (ксикаин, тримекаин), в том числе алкалоидов (морфина гидрохлорид, эфедрина гидрохлорид). Прямую аргентометрию используют также для количественного определения иодметилатов органических оснований (метацин) и веществ, образующих соли с нитратом серебра: некоторых сульфаниламидных препаратов, n-аминосалицилата натрия, меркаптопурина и др. Многие лекарственные вещества содержат атомы галогенов, связанные с органической частью молекулы ковалентной связью. Такие соединения обычно определяют методом тиоцианатометрии после кипячения с титрованным раствором AgNO3 (иодоформ, хлорбутин), щелочного или восстановительного дегалогенирования (бромизовал, бромкамфора и др.)
Исходный уровень знаний:
Для усвоения материала данной темы необходимо знать:
Равновесия в гетерогенных системах.
Произведения растворимости.
Условия образования и растворения осадка. Факторы, влияющие на полноту осаждения.
Требования, предъявляемые к реакциям в осадительном титровании.
Индикаторы методов осадительного титрования. Классификация методов в зависимости от типа титранта и от типа индикатора.
Литература:
Харитонов Ю.Я. Аналитическая химия. Аналитика Т.2. М.: Высшая школа. 2005 – с. 245 – 268.
Пономарев В.Д. Аналитическая химия. М.: Высшая школа, 1982, ч.1, с. 109 – 128; ч.2, с.78 – 90.
Пономарев В.Д., Иванова Л.И., Самокиш И.И. и др. Практикум по аналитической химии М.: Высшая школа, 1983, с. 170 – 176.
Беликов В.Г. Фармацевтическая химия. М.: Высшая школа, 1985, с.125 – 126.
Васильев В.И. Аналитическая химия. М.: Высшая школа, 1989, ч.1, с.256 – 261.
Конспект лекций по неорганической, органической и аналитической химии.
Сборник расчетных задач по количественному анализу, Ярославль, ЯГМА, 1999 г.
Блок информации:
В основу методов осаждения положены реакции, сопровождающиеся образованием малорастворимых соединений. Реакции применимы при условии, что протекают до конца (ПР образующегося осадка ≤ 10-8), с высокой скоростью, не осложняются процессами адсорбции ионов на образующихся осадках. Очень важным условием является возможность фиксирования точки эквивалентности.
В фармацевтическом анализе наиболее широко используют аргентометрическое и тиоцианатометрическое титрование. (В последнее время всвязи с дефицитом серебра вместо аргентометрии вводят меркурометрию).
Аргентометрия основана на реакции осаждения галогенид-ионов раствором AgNO3 , например
AgNO3 + КСI AgСI + КNO3
Основным рабочим раствором является раствор нитрата серебра, концентрацию которого устанавливают по стандартному раствору КСI (NaCI). Последний готовят по точной навеске.
Различают безиндикаторное титрование (метод Гей-Люссака), титрование с индикатором – хроматом калия (метод Мора) и с флуоресцеином или эозином (метод Фаянса).
При титровании методом Мора в точке эквивалентности в растворе появляется кирпично-красное окрашивание вследствие образования осадка Ag2CrO4. Титрование проводят в нейтральной среде, так как в кислой среде K2CrO4 переходит в K2Cr2O7, не обладающий индикаторными свойствами. В щелочной среде выпадает осадок Ag2O. Методом Мора анализируют лекарственные препараты КСI, КBr, NaСI, NaBr и др. Иодиды определять нельзя, так как осадок AgI адсорбирует индикатор до точки эквивалентности. Определению мешают анионы, образующие цветные осадки с AgNO3 (S2-, PO43 -, AsO33 -, AsO43 -), также некоторые катионы (Ba2+, Pb2+), образующие осадки с K2CrO4, аммиак и соли аммония, органические соединения – восстановители.
Методом тиоцианатометрии (титрование по Фольгарду) определяют галогениды и тиоцианаты. Прямым титрованием раствором KSCN (NH4SCN) можно определить ионы Ag+ и Hg22+. Титрант-раствор KSCN (NH4SCN) готовится по приближенной навеске и стандартизируется по титрованному раствору AgNO3(Hg2(NO3)2). Молярная масса эквивалента и молярная масса у тиоцианата калия (аммония) совпадают. При определении КBr по Фольгарду протекают следующие реакции:
КBr +

AgBr
+ КNO3
AgBr
+ КNO3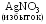 + NH4SCN
AgSCN
+ NH4NO3
+ NH4SCN
AgSCN
+ NH4NO3
Таким образом, метод Фольгарда – обратное титрование. (Многие авторы не называют этот метод тиоцианатометрией, а говорят об обратной аргентометрии).
Индикатором является раствор железо-аммонийных квасцов – (NH4) Fe(SO4)212Н2О.В точке эквивалентности появляется бледно-красное окрашивание вследствие реакции:
Fe+3 + SCN- Fe(SCN)2+
Титрование проводят в кислой среде (HNO3), чтобы подавить гидролиз индикатора. При определении хлоридов учитывают, что осадок AgСI имеет повышенную (относительно других галогенидов серебра) растворимость, сравнимую с растворимостью осадка AgSCN. Поэтому для предотвращения реакции:
AgСI + SCN- ⇄ AgSCN + СI-
применяют добавки нитробензола, который хорошо адсорбируется на осадке AgСI и препятствует его растворению.
Лабораторная работа №14 (УИРС). Определение массы хлорида натрия в растворе методом Мора.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл,1 мл.
Мерные колбы 100 мл.
Конические колбы для титрования.
Промывалки и капельницы с водой очищенной.
Реактивы: 0,05 н. титрвоанный раствор AgNO3, 5% раствор K2Cr2O4.
Основные этапы работы
|
Последователь ность операций |
Содержание операций |
Формы самоконтроля |
|
1 |
2 |
3 |
|
Полученный в виде задачи раствор разбавляют водой очищенной в мерной колбе до 100 мл и тщательно перемешивают. В три конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора и другой мерной пипеткой 0,5 мл раствора индикатора K2CrO4.
Проводят три титрования 0,05 н. раствором AgNO3 до появления кирпично-красного оттенка раствора. Находят средний объем титранта.
Рассчитывают массу NaCl в растворе по формуле:
где M(NaCl) = 58,5 г/моль – молярная масса эквивалента NaCl; V(NaCl) – объем раствора задачи, взятый на титрование, мл; Vк – объем мерной колбы, мл. ответ по работе оформляют в соответствии с вышеприведенной схемой. Полученный результат сдают преподавателю, рассчитывают величину относительной ошибки. |
Раствор в колбах приобретает желтую окраску.
Последние капли титранта добавляют медленно, при интенсивном перемешивании. Результаты параллельных титрований не должны отличаться более чем на 0,05 мл.
|
Лабораторная работа №15 (УИРС). Определение массы бромида калия в растворе методом Фольгарда.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл, 2 мл.
Мерные колбы 100 мл.
Конические колбы для титрования.
Капельницы с водой очищенной.
Промывалки.
Реактивы: 0,05 н. титрованные растворы AgNO3 и NH4SCN, 2н. раствор HNO3, раствор индикатора – железоаммонийных квасцов.
Основные этапы работы
|
Последователь ность операций |
Содержание операций |
Формы самоконтроля |
|
1 |
2 |
3 |
|
Полученный в виде задачи раствор разбавляют водой очищенной в мерной колбе до 100 мл и тщательно перемешивают. В три конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора и бюреткой по 15 мл отмеривают 0,05 н. титрованного раствора AgNO3. В каждую колбу добавляют по 2 мл 2н. HNO3 и по 2 мл раствора железоаммонийных квасцов. Растворы тщательно перемешивают.
Проводят три титрования 0,05 н. раствором NH4SCN до появления бледно-оранжевого окрашивания титруемого раствора. Находят средний объем титранта.
Рассчитывают массу KBr в растворе по формуле:
где M(KBr) = 119,0 г/моль – молярная масса эквивалента KBr. V(KBr) - объем раствора задачи, взятый на титрование, мл; Vk – объем мерной колбы, мл. Отчет по работе оформляют в соответствии с вышеприведенной схемой. Полученный результат сдают преподавателю, рассчитывают величину относительной ошибки.
|
В колбах образуется бледно-желтый осадок, который после добавления HNO3 и перемешивания должен скоагулировать.
Последние капли титранта добавляют медленно, при интенсивном перемешивании Результаты параллельных титрований не должны отличаться более чем на 0,05 мл. |
Вопросы для контроля усвоения темы:
В чем сущность методов осаждения? Перечислите требования к реакциям в осадительном титровании.
Как классифицируются методы осадительного титрования по типу титранта? Перечислите методы, названные по имени ученых, впервые их предложивших.
Как приготовить растворы AgNO3, NaCl, NH4SCN, Hg2(NO3)2 и определить их точные концентрации?
Какие индикаторы применяются в аргентометрии? В каких методах?
В чем сущность безиндикаторного титрования по Гей-Люссаку?
Как фиксируется точка эквивалентности при титровании по методу Мора? Почему осадок Ag2CrO4 не выпадает до точки эквивалентности?
Как будет зависеть точность титрования по методу Мора от температуры, произведения растворимости образующегося осадка, концентраций титранта и титруемого вещества?
Почему титрование по методу Мора проводят в нейтральной среде?
В каком порядке будут выпадать осадки при аргентометрическом определении смеси, содержащей Cl-, Br- и I- - ионы одинаковой концентрации? Какой вид будет иметь кривая титрования?
Приведите уравнения реакций, протекающих при титровании KBr по Фольгарду.
Почему титрование по методу Фольгарда проводят в среде азотной кислоты?
Как фиксируется точка эквивалентности при титровании по методу Фольгарда?
В каком методе осадительного титрования используются адсорбционные индикаторы? Каков механизм их действия?
Какие адсорбционные индикаторы можно использовать при титровании:
а) KBr; б) KCl; в) KI?
Сравните преимущества и недостатки методов Мора и Фольгарда при определении галогенидов.
Какие индикаторы используются в меркурометрии? Какие вещества можно определить этим методом?
Сравните преимущества и недостатки методов аргентометрии и меркурометрии.
Перечень практических навыков.
Уметь:
Брать навеску вещества на аптечных и аналитических весах.
Готовить раствор в мерной колбе.
Отмеривать раствор пипеткой.
Проводить титрование из бюретки.
Проводить количественное определение галогенидов методами аргентометрии и тиоцианатометрии.
Задания по теме «Методы осадительного титрования», выносимые для проверки практических навыков:
Установить поправочный коэффициент и титр 0,05 н. AgNO3 по хлориду натрия. Титрование провести способами аликвотных проб и отдельных навесок.
Определить массовую долю KBr (NaCl, KCl) в растворе методом Мора. Титрование провести способами аликвотных проб и отдельных навесок.
Определить массовую долю KBr (NaCl, KCl) в веществе методом Фольгарда. титрование провести способами аликвотных проб и отдельных навесок.


