
- •Содержание
- •Тема: Гравиметрический анализ
- •Тема: Кислотно–основное титрование
- •Тема: Методы окислительно-восстановительного титрования. Иодометрия
- •Тема: Броматометрическое титрование
- •Тема: Нитритометрия
- •Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
- •Тема: Комплексонометрия.
- •Электив « методы аналитической химии»
- •Методические рекомендации
- •Ход определения
- •Ход определения
- •Методические рекомендации
- •К учебно-исследовательской работе № 5
- •« Определение содержания кальция и магния в
- •Растворе при их совместном присутствии»
- •Ход определения
- •Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
- •Методические рекомендации
- •Приложение
Тема: Комплексонометрия.
Цель изучения данной темы:
Усвоить основы комплексонометрического титрования, выработать практические навыки определения ионов металлов в растворе, необходимые в анализе некоторых фармацевтических препаратов. Уметь решать расчетные задачи, связанные с методом комплексонометрии.
Практическая значимость:
Комплексонометрия позволяет определять практически все металлы Периодической системы Д.И.Менделеева. Метод является одним из основных фармакопейных методов анализа лекарственных веществ. Так, ГФХ рекомендует комплексонометрию для количественного определения неорганических фармакопейных препаратов магния (магния сульфат, магния карбонат основной, магния оксид), цинка (цинка оксид, цинка сульфат), кальция (кальция хлорид), висмута(висмута нитрат основной). Аналогично определяют кальциевые соли органических кислот (кальция лактат, кальция глюконат, кальция пангамат и др.) Знание метода весьма необходимо и для токсикологического анализа (определение «металлических» ядов).
Исходный уровень знаний:
Для усвоения материала данной темы необходимо знать:
Основные положения теории комплексных соединений (неорганическая химия).
Равновесие в растворах комплексных соединений. Константы образования и нестойкости комплексных соединений. Условные константы.
Комплексоны, их свойства.
Металлоиндикаторы, механизм их действия.
Буферные системы.
Литература:
Харитонов Ю.Я. Аналитическая химия. Аналитика Т.2. М.: Высшая школа. 2005 – с. 209 – 243.
2. Пономарев В.Д. Аналитическая химия. М.: Высшая школа, 1982, ч.1, с. 59 – 61; 63 - 76 ч.2, с.90 – 105.
3. Пономарев В.Д., Иванова Л.И., Самокиш И.И. и др. Практикум по аналитической химии М.: Высшая школа, 1983, с. 181 – 183.
4. Беликов В.Г. Фармацевтическая химия. М.: Высшая школа, 1985, с.134 – 135.
5. Конспект лекций по неорганической, органической и аналитической химии.
6. Сборник типовых задач по количественному анализу с примерами решений, Ярославль, ЯГМА, 1999 г.
V. Блок информации.
В основе комплексонометрии лежат реакции образования прочных и хорошо растворимых в воде внутрикомплексных соединений ионов металлов с комплексонами. Комплексоны – органические соединения – аминополикарбоновые кислоты и их соли. Хотя число различных комплексонов составляет не одну сотню, наибольшее значение из них имеют:
Комплексон
I
(нитрилотриуксусная кислота),
сокращенно H3Y
Комплексон
II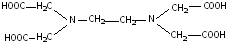
(этилендиаминтетра-
уксусная кислота),
сокращенно H4Y
Комплексон
III

(динатриевая соль
этилендиаминтетра-
уксусной кислоты),
сокращенно Na2H2Y
Очень важным является то, что реакции комплексообразования аминополикарбоновых кислот с ионами металлов проходят стехиометрически с образованием лишь одного комплексного соединения, т.е. отсутствует ступенчатость. Особенно широко применяют комплексон III (трилон Б, ЭДТА).
Степень комплексообразования ЭДТА с ионами металлов существенно зависит как от устойчивости комплексов, так и от рН раствора. Так, для титрования катионов, образующих неустойчивые комплексы (Ca2+, Mg2+), требуется щелочная среда, которую обычно создают добавлением аммиачного буферного раствора (рН = 9-10). При этом ЭДТА в растворе находится в виде иона HY3-, и реакция комплексообразования существенно облегчается:
Ca2+ + HY3 – [CaY]2 – + H+
Титрование катионов, образующих более устойчивые комплексы (Fe3+, Ni2+, Co2+ и др.), можно успешно провести в умеренно- кислой среде:
Fe3+ + H2Y2 – [FeY] – + 2H+
Zr4+ + H2Y2 – [ZrY] + 2H+
Во всех реакциях 1 моль металла, независимо от степени окисления, всегда связывает 1 моль комплексона. Поэтому количество определяемого вещества всегда равно количеству ЭДТА, вступившего в реакцию, т.е. С(Me)VMe = C(ЭДТА)VЭДТА, чем и пользуются при расчетах.
В качестве
индикаторов используют металлоиндикаторы
(металлохромные) – вещества, образующие
с ионами металлов интенсивно окрашенные
комплексные соединения, например,
мурексид, ксиленоловый оранжевый,
эриохром черный Т и др. Из них очень
широкое применение нашел эриохром
черный Т, относящийся к группе азокрасителей
и имеющий в молекуле хелатообразующие
ОН-группы:
Протон сульфогруппы в растворе диссоциирует практически нацело. Окраска индикатора зависит от рН раствора

Комплексы металлов с эриохромом, в основном, красно-фиолетового цвета. Поэтому индикатор пригоден для титрования только при рН 7, где преобладает форма HInd2 – синего цвета. При добавлении к титруемому раствору незначительная часть ионов металла связывается в комплексе:
Me2+
+

 +H+
+H+
При титровании с эриохромом черным Т вблизи точки эквивалентности протекает реакция:
 + HY3 –
[MeY]2 –
+
+ HY3 –
[MeY]2 –
+

Раствор меняет цвет с красно-фиолетового на синий. Устойчивость комплекса металла с индикатором должна быть в 10 раз меньше, чем комплекса металла с ЭДТА, иначе титрование закончится преждевременно.
Титрантами в комплексонометрии являются 0,1 М, 0,01 М,
0,005 М растворы ЭДТА, а также растворы MgSO4 и ZnSO4 соответствующих концентраций. Раствор ЭДТА готовят по точной навеске из химически чистого вещества (МЭДТА = 372 г/моль). Титр устанавливают либо по навеске, либо прямым титрованием стандартного раствора ZnSO4(MgSO4) в присутствии эриохрома и аммиачного буферного раствора:
Mg2+ + HY3 – [MgY]2 – + H+
Растворы ZnSO4 и MgSO4 готовят по точной навеске (исходные вещества Zn, ZnSO47H2O, MgO, MgSO47H2O) и при необходимости стандартизируют по титрованному раствору ЭДТА.
В зависимости от устойчивости комплексных соединений определяемого металла с ЭДТА и индикатором применяют методы прямого и обратного титрования, а также метод замещения. Прямое титрование используют для определения ионов металлов, быстро реагирующих с ЭДТА при условии, что существует индикатор для определения конечной точки титрования. Обратное титрование применяют для определения катионов, образующих с ЭДТА очень устойчивые комплексы, для титрования которых нельзя подобрать подходящие индикаторы. В этом случае избыток ЭДТА определяют обратным титрованием стандартным раствором MgSO4(ZnSO4) в присутствии эриохрома. Например, при определении ионов Pb2+ протекают следующие реакции:
Pb2+
+

[PbY]2 –
+ H+
[PbY]2 –
+ H+
 + Mg2+
[MgY]2 –
+ H+
+ Mg2+
[MgY]2 –
+ H+
При заместительном титровании в титруемый раствор вводят избыток комплекса ЭДТА с ионами Mg2+(или Zn2+). Если определяемый катион образует с ЭДТА более устойчивый комплекс, чем Mg2+( Zn2+), то протекает реакция:
Me2+ + [MgY]2 – [MeY]2 – + Mg2+
Выделившиеся ионы Mg2+ титруют стандартным раствором ЭДТА. Метод используют при отсутствии подходящего индикатора для прямого титрования определяемого иона металла.
VI. Лабораторная работа №16. Стандартизация раствора ЭДТА по сульфату магния.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл.
Конические колбы для титрования.
Химические воронки Ø 40-50 мм
Промывалки с водой очищенной.
Мерные цилиндры 10 мл.
Реактивы: 0,05 M стандартный раствор MgSO4, 0,05M раствор ЭДТА, аммиачный буферный раствор, индикатор эриохром черный Т.
Основные этапы работы
|
Последовательность операций |
Содержание операций |
Формы самоконтроля |
|
1 |
2 |
3 |
|
В три колбы для титрования мерной пипеткой отбирают по 10 мл стандартного 0,05 M раствора MgSO4, мерным цилиндром 5 мл аммиачного буферного раствора и на кончике шпателя индикатор – эриохром черный Т.
Титруют раствор MgSO4 раствором ЭДТА при энергичном перемешивании до перехода окраски в сине-зеленую. Проводят три титрования, рассчитывают средний объем.
Рассчитывают концентрацию и титр ЭДТА:
где М(ЭДТА) = 372 г/моль – молярная масса ЭДТА; Отчет по работе оформляют по вышеприведенной схеме. Полученные результаты сдают преподавателю. |
Раствор в колбах окрашивается в красно-фиолетовый цвет за счет образования ионов [MgInd]-
Концом титрования считают момент, когда раствор изменяет окраску от красно-фиолетовой через фиолетовую в сине-зеленую. Результаты параллельных титрований не должны отличаться более, чем на 0,05 мл. |
VII. Лабораторная работа №17 (УИРС). Определение массы свинца в растворе методом обратного комплексонометрического титрования.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл, 20 мл.
Мерные колбы 100 мл.
Конические колбы для титрования.
Химические воронки Ø 40-50 мм
Капельницы с водой очищенной.
Промывалки с водой очищенной.
Мерные цилиндры 10 мл.
Электроплитки.
Реактивы: 0,05 М раствор MgSO4, 0,05 М титрованный раствор ЭДТА, аммиачный буферный раствор, индикатор эриохром черный Т.
Основные этапы работы.
|
Последовательность операций |
Содержание операций |
Формы самоконтроля | |
|
1 |
2 |
3 | |
|
Полученный в виде задачи раствор разбавляют водой в мерной колбе до 100 мл и тщательно перемешивают. В три конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора и другой мерной пипеткой по 20 мл титрованного 0,05 М раствора ЭДТА. В каждую колбу посредством мерного цилиндра добавляют по 2 мл аммиачного буферного раствора. Колбы ставят на электроплитку, растворы нагревают до кипения и кипятят в течение 1 мин, затем охлаждают до комнатной температуры, добавляют еще 5 мл аммиачного буферного раствора и на кончике шпателя индикатор – эриохром черный Т. Содержимое тщательно перемешивают.
Титруют стандартным 0,05 М раствором MgSO4 при энергичном перемешивании до перехода окраски в красно-фиолетовую. Проводят три титрования, рассчитывают средний объем.
Рассчитывают массу свинца в растворе по формуле:
где М(Pb) = 207 г/моль – молярная масса свинца. Vk – объем мерной колбы, мл; V(Pb) – объем раствора задачи на титрование. Отчет по работе оформляют по вышеприведенной схеме. Полученные результаты сдают преподавателю, рассчитывают величину относительной ошибки. |
После добавления индикатора растворы окрашиваются в синий цвет вследствие образования иона HInd2-. Окраска не должна быть очень темной. Не должно быть сильного кипячения.
Необходимо добиться постоянной красно-фиолетовой окраски, не изменяющейся при добавлении последующих порций титранта. Результаты параллельных титрований не должны отличаться более чем на 0,05 мл. | |
VIII Вопросы для контроля усвоения темы:
В чем сущность метода комплексонометрии?
Приведите примеры комплексонов. Почему они так называются?
Напишите структурную формулу комплекса ЭДТА с ионами Mg2+.
Какие рабочие растворы используются в комплексонометрии? Как правильно приготовить и провести стандартизацию 0,05М раствора ЭДТА?
Как влияет рН титруемого раствора на ход определения методом комплексонометрии?
Для чего при комплексонометрическом титровании применяют буферные растворы?
Напишите уравнения реакций комплексонометрического определения Bi3+ в кислой среде и Ca2+ в щелочной среде.
Как влияют на точность комплексонометрического титрования:
а) концентрации титранта и титруемого вещества;
б) рН титруемого раствора;
в) константа образования комплексного соединения металла с ЭДТА?
Почему комплексонометрическое титрование ионов Mg2+ проводят в щелочной среде, а ионов Fe3+ - в кислой?
В чем сущность прямого, обратного и заместительного титрования по методу комплексонометрии?
Приведите уравнения реакций, протекающих при определении ионов свинца методом обратного титрования.
Напишите уравнения реакций, протекающих при комплесонометрическом титровании ионов никеля методом замещения.
Какие металлоиндикаторы применяются в комплексонометрии?
Напишите структурную формулу комплекса эриохрома черного
Т с ионами Mg2+.
Почему титрование с эриохромом черным Т проводят в слабощелочной среде? Как изменяется окраска раствора при титровании трилоном и при титровании трилона Б?
Почему комплекс ионов металла с индикатором должен быть менее устойчив, чем комплекс ионов металла с ЭДТА?
В чем сущность определения общей жесткости воды методом комплексонометрии?
Составьте методику комплексонометрического определения ионов Zn2+ в растворе.
IX. Перечень практических навыков:
Уметь:
Брать навеску вещества на аптечных и аналитических весах.
Готовить раствор в мерной колбе.
Отмеривать раствор пипеткой.
Проводить титрование из бюретки.
Проводить количественные определения ионов металлов методом комплексонометрии.
Задания по теме «Комплексонометрия», выносимые для проверки практических навыков:
Установить поправочный коэффициент и титр 0,05М раствора ЭДТА по сульфату магния. Титрование провести способами аликвотных проб и отдельных навесок.
Определить массовую долю ZnO (MgO, ZnSO4∙7H2O, CaCO3) в веществе методом комплесонометрии. Титрование провести способами аликвотных проб и отдельных навесок.
Определить массовую долю CaCl2 в растворе методом комплексонометрии. Титрование провести способами аликвотных проб и отдельных навесок.


