
- •Содержание
- •Тема: Гравиметрический анализ
- •Тема: Кислотно–основное титрование
- •Тема: Методы окислительно-восстановительного титрования. Иодометрия
- •Тема: Броматометрическое титрование
- •Тема: Нитритометрия
- •Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
- •Тема: Комплексонометрия.
- •Электив « методы аналитической химии»
- •Методические рекомендации
- •Ход определения
- •Ход определения
- •Методические рекомендации
- •К учебно-исследовательской работе № 5
- •« Определение содержания кальция и магния в
- •Растворе при их совместном присутствии»
- •Ход определения
- •Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
- •Методические рекомендации
- •Приложение
Ход определения
Полученный от преподавателя раствор задачи доводят в мерной колбе дистиллированной водой до 100 мл. В три колбы для титрования мерной пипеткой отбирают по 10 мл приготовленного растворами добавляют 4-5 капель индикатора фенолфталеина. Титруют первую колбу раствором HCl до обесцвечивания фенолфталеина, фиксируют объем по бюретке V1, добавляют в колбу для титрования 3-4 капли метилоранжа и, не доливая бюретки, дотитровывают до перехода окраски из желтой в красно-оранжевую. Фиксируют объем V2. Аналогичным образом оттитровывают растворы во второй и третьей колбах. Находят V1(ср) и V2(ср). Массы NaHCO3 и Na2CO3 рассчитывают по формулам:
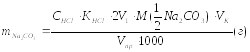

Полученные результаты сообщают преподавателю, рассчитывают величину относительной ошибки.
Методические рекомендации
К учебно-исследовательской работе № 5
« Определение содержания кальция и магния в
Растворе при их совместном присутствии»
Сущность метода сводится к тому, что вначале проводят определение суммарного содержания ионов Ca2+ и Mg2+, титруя смесь раствором ЭДТА в присутствии аммиачного буфера ( pH=9, 8÷10) и индикатора эриохрома черного Т. Затем находят содержания только ионов Ca2+ титруя вторую порцию смеси раствором ЭДТА в присутствии индикатора мурексида в сильнощелочной среде
( pH=12÷13). В этом диапазоне pH комплекс ионов Ca2+ с ЭДТА устойчив, а комплекс ионов Mg2+ с ЭДТА разрушается и магний выделяется в виде гидроксида. Содержание ионов Mg2+ находят по разности двух определений.
Реактивы: 0,05 М титрованный раствор ЭДТА, аммиачный буферный раствор, 20% раствор NaOH, сухие индикаторы – эриохром черный Т и мурексид в смеси с NaCl.
Посуда: мерные колбы 200 мл, мерные пипетки 20 мл, мерные бюретки 25 мл, конические колбы для титрования, мерные цилиндры.
Ход определения
Полученный от преподавателя раствор задачи разбавляют в мерной колбе до 200 мл и тщательно перемешивают. В три конические колбы для титрования мерной пипеткой переносят по 20 мл приготовленного раствора, добавляют 5 мл аммиачного буферного раствора ( мерным цилиндром) и сухой индикатор эриохром до отчетливой виyно-красной окраски. Титруют стандартным раствором ЭДТА до перехода окраски в синюю. Рассчитывают средний объем – V1.
Для определения кальция 20 мл анализируемого раствора мерной пипеткой переносят в колбу для титрования, добавляют 5 мл 20% раствора NaOH и сухой индикатор – мурексид до интенсивно-розовой окраски. Титруют стандартным раствором ЭДТА до перехода окраски в постоянную фиолетовую. Проводят три титрования, определяют средний объем – V2. Содержание кальция и магния определяют по формулам:


Полученные результаты сообщают преподавателю, рассчитывают величину относительной ошибки.
Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
Блок информации:
Метод титрования в неводных средах широко представлен в ГФХ для многих лекарственных препаратов.
Преимущество метода неводного титрования состоит в том, что он позволяет определять вещества, которые в водной среде бывает практически невозможно определить методом нейтрализации либо вследствие плохой растворимости этих веществ, либо в виду нечеткого перехода окраски индикатора в эквивалентной точке, либо из-за нейтрального характера некоторых солей.
Подбирая определенные неводные растворители, можно оттитровать любые кислоты и основания независимо от величины их констант диссоциации.
Преимущество метода кислотно-основного титрования в неводных средах состоит и в том, что он позволяет определять соли органических оснований или кислот по физиологически активной части молекулы.
Одним из распространенных и широко применяемых неводных растворителей для количественного определения веществ основного характера является ледяная (безводная) уксусная кислота, а титрантом- хлорная кислота; индикатор- кристаллический фиолетовый.
Титрование соединений кислого характера проводят обычно в среде диметилформамида, который усиливает кислотные свойства слабых кислот.
В качестве титранта в этом случае используют 10,1 н раствор метилата натрия или калия в смеси бензола с метанолом или 0,1 н раствор NaOH в смеси метилового спирта и бензола. Индикатором служит тимоловый синий.
В основу теории неводного титрования положена протонная теория Бренстеда- Лоури, согласно которой нейтрализация рассматривается как процесс, сопровождающийся переходом протона кислоты к основанию.
Любой растворитель может выполнять функцию кислоты или основания в зависимости от характера растворенного в нем вещества. Например, вода в присутствии аммиака является кислотой, так как отдает свой протон, превращаясь в основание (OH-):

кислота основание кислота основание
В присутствии же CH3COOH вода выполняет функцию основания, так как принимает протон от кислоты превращаясь в ион оксония с функциями кислоты:

 кислота
основание кислота основание
кислота
основание кислота основание
Таким образом, вода по теории Бренстеда- Лоури может быть и основание и кислотой в зависимости от характера растворенного в ней вещества.
Следовательно, кислотность и основность определенного вещества изменяются в зависимости от основности или кислотности среды, в которую оно помещено. Одни и те же вещества в одном растворителе ведут себя как кислоты, в другом – как основания.
В зависимости от кислотно-основного характера растворителей их делят на следующие группы:
1. Амфитропные, или амфотерные: H2O, CH3OH, C2H5OH и др. Эти растворители играют роль основания по отношению к кислотам и роль кислоты по отношению к основаниям.
2. Протогенные, или кислотные: HF,H2SO4, HCOOH, CH2COOH и другие вещества кислотного характера. Молекулы протогенных растворителей склонны отдавать свои протоны и превращаться в основания:

3. Протофильные, или основные: NH3, H2N-NH2, H2N(CH2)2NH2, HCON(CH2)2 и другие вещества основного характера. Молекулы протофильных растворителей отличаются большим сродством к протону и поэтому легко присоединяют протоны:


Апротонные, или апротные: C2H5, C6H12, CCl4 и другие вещества нейтрального характера, молекулы которых неспособны отдавть, ни присоединять протоны, так как молекулы апротонных растворителей не диссоциированны.
