
- •Содержание
- •Тема: Гравиметрический анализ
- •Тема: Кислотно–основное титрование
- •Тема: Методы окислительно-восстановительного титрования. Иодометрия
- •Тема: Броматометрическое титрование
- •Тема: Нитритометрия
- •Тема: Методы осадительного титрования. Аргентометрия (метод Мора). Тиоцианатометрия (метод Фольгарда)
- •Тема: Комплексонометрия.
- •Электив « методы аналитической химии»
- •Методические рекомендации
- •Ход определения
- •Ход определения
- •Методические рекомендации
- •К учебно-исследовательской работе № 5
- •« Определение содержания кальция и магния в
- •Растворе при их совместном присутствии»
- •Ход определения
- •Методические рекомендации к учебно-исследовательской работе №6 «Наводное титрование»
- •Методические рекомендации
- •Приложение
Тема: Кислотно–основное титрование
I. Цель изучения данной темы:
Научиться готовить растворы титрантов, проводить их стандартизацию. Уметь использовать метод кислотно – основного титрования для определения концентрации кислот, оснований и других веществ.
II. Практическая значимость:
Кислотно – основное титрование – быстрый и достаточно точный метод анализа веществ, обладающих кислотными или основными свойствами в водной или неводной среде. Методики, основанные на кислотно – основном титровании, используют для определения более 40% фармакопейных лекарственных веществ.
Применяя в качестве титрантов растворы кислот в водной и неводной среде (ацидиметрия), можно количественно определить многие лекарственные вещества: натрия бензоат, натрия салицилат, ряд барбитуратов, некоторые органические основания (амидопирин, никотинамид, фтивазид), алкалоиды (кодеин, резерпин, кофеин), соли органических оснований (адреналина, нафтизина, атропина сульфаты, кодеина фосфат) и др.
Алкалиметрию (титрант - основание) широко используют для определения лекарственных веществ, представляющих собой неорганические и органические кислоты (соляная, борная, лимонная, салициловая, многие аминокислоты), а также фенолов, барбитуратов, гидрохлоридов органических оснований (димедрол, дибазол, промедол), алкалоидов (папаверина, эфедрина, пилокарпина гидрохлориды), витаминов и других веществ.
Имеются косвенные методы, например, определение азота в веществе по Къельдалю, позволяющие проводить количественный анализ веществ, не обладающих свойствами кислот и оснований.
III. Исходный уровень знаний:
Для усвоения материала данной темы необходимо знать:
Основные положения протолитической теории Бренстеда – Лоури.
Расчет рН и равновесных концентраций веществ в растворах протолитов.
Способы выражения концентраций растворов в титриметрии.
Приемы и способы титрования (прямое, обратное, заместительное титрование, способ аликвотных проб и отдельных навесок).
Стандартные (установочные) вещества, требования к ним.
Принцип фиксирования конца титрования. рН – индикаторы.
Технику взвешивания на аналитических демпферных весах и работы с мерной аналитической посудой.
IV. Литература:
Харитонов Ю.Я. Аналитическая химия. Аналитика Т.2. М.: Высшая школа. 2005 – с. 68 – 128.
Пономарев В.Д. Аналитическая химия. М.: Высшая школа, 1982, ч.1, с. 37 – 63; ч.2, с. 44 – 77.
Беликов В.Г. Фармацевтическая химия, М.: Высшая школа 1985, с. 127 – 131.
Пономарев В.Д., Иванова Л.И., Самокиш И.И. и др. Практикум по аналитической химии М.: Высшая школа, 1983, с. 156 – 167.
Конспект лекций по количественному анализу.
Сборник расчетных задач по количественному анализу с примерами решений, Ярославль, ЯГМИ, 1994 г.
IV. Блок информации:
Метод кислотно – основного титрования основан на реакции взаимодействия между протолитами – кислотами и основаниями по Бренстеду, которое в общем виде можно представить как:
НА + В ↔ А- + ВН+
к-та 1 осн.2 осн.1 к-та 2
В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. В ацидиметрии титрантами являются кислоты (HCl, H2SO4), в алкалиметрии – основания (NaOH, KOH, Ba(OH)2). Растворы кислот готовят разбавлением более концентрированных растворов с последующей стандартизацией по карбонату натрия и по буре. Растворы щелочей также готовят из более концентрированных, либо по приближенной навеске с последующей стандартизацией по щавелевой (янтарной) кислоте.
Определение конечной точки в методе кислотно – основного титрования основано на резком изменении рН раствора, которое наблюдается вблизи точки эквивалентности. Значение рН в точке эквивалентности зависит от силы реагирующих кислоты и основания. При титровании сильной кислоты сильным основанием это значение равно 7, если сильной кислотой титруют слабое основание, точка эквивалентности лежит в слабо – кислой среде; в случае сильного основания и слабой кислоты – в слабощелочной. Так как кислотно – основная реакция не сопровождается внешним эффектом (изменением окраски раствора), точку эквивалентности определяют с помощью индикаторов, окраска которых зависит от рН. Выбирая индикатор, интервал перехода окраски которого лежит вблизи точки эквивалентности (в пределах скачка титрования) можно достаточно точно определить конец реакции.
Для кислотно – основного титрования, как и для других методов, подходят только те реакции, которые являются практически необратимыми и протекают без образования побочных продуктов. Прямое кислотно – основное титрование применяют при определении кислот и оснований различной силы, хорошо растворимых в воде или в подходящем растворителе, если условия титрования позволяют достаточно точно зафиксировать окончание реакции. Так, например, можно провести стандартизацию титранта – раствора H2SO4 по буре. Титруют стандартный раствор или навеску буры раствором H2SO4 в присутствии метилоранжа до перехода желтой окраски раствора в бледно – малиновую:
Na2B4O7 + 5H2O + H2SO4 → Na2SO4 + 4H3BO3
Если прямое титрование невозможно (титруют очень слабые протолиты или вещества, не обладающие кислотно – основными свойствами, плохо растворимые в воде) применяют обратное или заместительное титрование. Например, обратным титрованием можно определить содержание NH3 в солях аммония, при этом аликвотную пробу раствора или навеску соли аммония обрабатывают избытком титрованного раствора NaOH:
NH4Cl + NaOH → NH3 + NaCl + H2O
После кипячения избыток щелочи оттитровывают стандартным раствором HCl. Содержание аммиака в хлориде аммония можно определить и методом замещения. В данном случае пробу, содержащую NH4Cl, обрабатывают избытком водного раствора формальдегида:
4NH4Cl + 6CH2O → (CH2)6N4 + 4HCl + 6H2O
Выделившуюся в эквивалентном количестве HCl оттитровывают стандартным раствором NaOH в присутствии фенолфталеина.
Примером анализа веществ, не обладающих кислотно – основными свойствами, является количественное определение кетонов.
Раствор, содержащий кетон, обрабатывают избытком раствора солянокислого гидроксиламина:
R1 – C = O + NH2OH∙HCl R1 – C = N – OH + HCl + H2O
׀ ׀
2R 2R
оксим кетона
Выделившуюся в эквивалентном количестве HCl титруют стандартным раствором щелочи в присутствии фенолфталеина.
VI. Лабораторная работа №4. Приготовление ~ 0,1 н. HCl из более концентрированного раствора. Стандартизация ~ 0,1 н. HCl по тетраборату натрия.
Материальное обеспечение:
Аналитические демпферные весы с разновесами.
Аптечные весы с разновесами.
Мерные бюретки 25 мл.
Мерные пипетки 10 мл.
Мерные колбы 100 мл.
Часовые стекла, стеклянные шпатели.
Конические колбы для титрования.
Химические воронки Ø 40 – 50 мм.
Склянки 250 мл и 500 мл.
Мерные цилиндры 10 мл, 250 мл, 500 мл.
Капельницы с водой очищенной.
Реактивы: HCl (конц.) 1:1; Na2B4O7∙10H2O (кристалл.); 0,1 н. стандартный раствор Na2B4O7∙10H2O; раствор индикатора – метилоранжа.
Основные этапы работы
|
Последовательность операций |
Содержание операций |
Формы самоконтроля | ||
|
1 |
2 |
3 | ||
|
Приготовление ~ 0,1 н. раствора HCl | ||||
|
Измеряют плотность раствора конц. HCl (1:1) с помощью ареометра под руководством преподавателя и по справочнику находят массовую долю HCl в растворе.
Рассчитывают объем HCl (1:1), необходимой для приготовления 250 мл или 500 мл ~ 0,1 н. раствора (по указанию преподавателя) m(HCl)безв.= С(HCl)·M(HCl)·V(р-ра), г
Рассчитанный объем конц. HCl посредством мерного цилиндра переносят в склянку вместимостью 250 мл (или 500 мл), доводят до метки водой очищенной и тщательно перемешивают.
|
Конц. HCl – едкое вещество, обращаться с осторожностью! ω (HCl) должна быть в пределах 16 – 20%.
На склянку предварительно нанести метку 250 мл (500 мл). Конц. HCl отмеривать с помощью мерного цилиндра 10 мл. | ||
|
Стандартизация ~ 0,1 н. HCl по тетраборату натрия способом аликвотных проб. | ||||
|
Мерную бюретку дважды промывают небольшим объемом ~ 0,1 н. HCl и заполняют ее этим раствором. Удаляют воздух из носика бюретки. Перед титрованием убирают воронку и устанавливают уровень жидкости на 0.
Мерную пипетку (10 мл) промывают стандартным раствором буры и отмеривают в 3 конические колбы для титрования по 10 мл этого раствора и по 2 – 3 капли индикатора – метилоранжа.
Титруют раствор буры соляной кислотой до появления розовой окраски. Na2B4O7+5H2O+2HCl=2NaCl+4H3BO3 Проводят три титрования, рассчитывают средний объем:
V1 = ….мл V2 = ….мл V3 = ….мл Vср =….мл
Рассчитывают точную молярную концентрацию эквивалента (нормальную концентрацию), титр и поправочный коэффициент для раствора HCl:
Для обозначения молярной концентрации эквивалента вещества X допустимо использовать символ Nx, а для обозначения молярной массы эквивалента - Эх. тогда вышеприведенные формулы можно представить в виде:
|
Бюретка не должна подтекать.
Последние капли раствора из пипетки не выдувать. Раствор в колбах должен окраситься в желтый цвет.
Показания с бюретки снимать с точностью до сотых долей мл. Результаты параллельных титрований не должны различаться между собой более чем на 0,05 мл! В противном случае число титрований увеличивают
Концентрация HCl должна быть рассчитана с точностью до 0,001, а титр с точностью до 0,000001. | ||
|
Стандартизация ~ 0,1 н. HCl по тетраборату натрия способом отдельных навесок. | ||||
|
Рассчитывают навеску буры, исходя из того, что на титрование этой навески должно быть израсходовано 15 мл 0,1 н. HCl:
где M(1/2Na2B4O7·10H2O) - молярная масса эквивалента буры – 190,69 г/моль
Рассчитанное количество тетрабората натрия взвешивают на аптечных весах, помещают на часовое стекло (или кальку) и взвешивают на аналитических весах с точностью до 0,0002 г. Вещество аккуратно пересыпают в коническую колбу для титрования, а часовое стекло (кальку) с остатками вещества вновь взвешивают на аналитических весах и по разности между первым и вторым взвешиванием определяют массу навески. Таким образом берут три навески.
В колбы для титрования отмеривают ~ по 10 мл воды очищенной и растворяют при перемешивании буру. В каждую колбу добавляют по 2 – 3 капли индикатора – метилоранжа.
Мерную бюретку дважды промывают небольшим объемом ~ 0,1 н. HCl и заполняют ее этим раствором. Удаляют воздух из носика бюретки.
Титруют раствор буры соляной кислотой. Окраска изменяется от желтой до розовой.
Для каждого титрования рассчитывают С(HCl), исходя из формулы:
Значение С(HCl) должны отличаться друг от друга не более чем в третьем знаке. Рассчитывают С(HCl) средн. (из трех значений), а также T(HCl) и K(HCl) (как это указано выше). В соответствии с вышеприведенной схемой оформляют отчет по работе. Полученные результаты сдают преподавателю. |
Взятые навески не обязательно должны совпадать с расчетной и быть равны между собой. Колбы для титрования необходимо пометить, чтобы знать какой объем титранта соответствует каждой навеске.
Вещество должно раствориться без остатка. При необходимости колбы слегка подогреть на электроплитке.
Бюретка не должна подтекать. Перед титрованием установить уровень жидкости на 0.
Показания с бюретки снимать с точностью до сотых долей мл.
Объемы трех титрований при разных навесках не совпадают. | ||
VII. Лабораторная работа №5 (УИРС): Определение массы серной кислоты в растворе.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл.
Мерные колбы 100 мл.
Химические воронки Ø 40 – 50 мм.
Конические колбы для титрования.
Промывалки и капельницы с водой очищенной.
Реактивы: 0,1 н. титрованный раствор NaOH, раствор индикатора – фенолфталеина.
Основные этапы работы.
|
Последователь ность операций |
Содержание операций |
Формы самоконтроля |
|
1 |
2 |
3 |
|
Полученный в виде задачи раствор разбавляют в мерной колбе (100 мл) водой очищенной до метки и тщательно перемешивают. В 3 конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора. Добавляют 2 – 3 капли индикатора – фенолфталеина.
Бюретку промывают раствором титранта и заполняют ее этим раствором. Удаляют воздух из носика бюретки, устанавливают уровень жидкости на нулевую отметку и титруют раствор до появления бледно-малиновой окраски раствора, не исчезающей в течение 30 сек. Проводят 3 титрования, рассчитывают средний объем: V1 = … мл V2 = … мл V3 = … мл Vср =… мл
Рассчитывают массу серной кислоты в растворе по формуле:
V (NaOH) – объем раствора NaOH, пошедший на титрование, мл. V(H2SO4) – объем титруемого раствора H2SO4, мл M(1/2H2SO4) – молярная масса эквивалента H2SO4 (49 г/моль). Vk – объем мерной колбы (мл), Отчет по работе оформляют в соответствии с вышеприведенной схемой. Полученный результат сдают преподавателю и рассчитывают величину относительной ошибки по формуле:
где mпракт. – полученный результат, г mтеор. – теоретический результат, г (сообщает преподаватель) |
Нижний мениск жидкости должен совпадать с меткой на колбе. Мерную пипетку промыть раствором задачи. Последние капли жидкости из пипетки не вытряхивать.
С воронкой не титровать! Результаты параллельных титрований не должны различаться между собой более чем на 0,05 мл, в противном случае число титрований увеличивают. |
VII. Лабораторная работа №6 (УИРС). Определение массовой доли аммиака в солях аммония формальдегидным методом.
Материальное обеспечение:
Мерные бюретки 25 мл.
Мерные пипетки 10 мл.
Мерные колбы 200 мл.
Мерные цилиндры 10 мл.
Конические колбы для титрования.
Химические воронки Ø 40 – 50 мм.
Промывалки и капельницы с водой очищенной.
Реактивы: 0,1 н. титрованный раствор NaOH, раствор формальдегида
(ω = 20%), раствор индикатора – фенолфталеина.
Основные этапы работы.
|
Последователь ность операций |
Содержание операций |
Формы самоконтроля |
|
1 |
2 |
3 |
|
Полученный в виде задачи раствор разбавляют в мерной колбе (200 мл) водой очищенной и тщательно перемешивают. В 3 конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора. в каждую колбу добавляют посредством мерного цилиндра 5 мл 20% раствора формальдегида и 2 – 3 капли фенолфталеина. 4NH4Cl+6CH2O→(CH2)6N4+4HCl+6H2O
Бюретку заполняют 0,1 н. раствором NaOH и титруют раствор задачи до появления бледно-малиновой окраски, не исчезающей в течение 30 сек. 4HCl + 4NaOH→ 4NaCl + 4H2O
Проводят 3 титрования, рассчитывают средний объем V1 = …мл V2 = …мл V3 = …мл Vср. = ...мл
Рассчитывают массовую долю аммиака в хлориде аммония по формуле:
где С(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л; V (NaOH) = объем раствора NaOH, пошедший на титрование, мл; V (NH4Cl) – объем титруемого раствора задачи, мл; Vk – объем мерной колбы; M(NH3) – молярная масса эквивалента аммиака (17 г/моль); g(NH4Cl) – навеска соли аммония, г (сообщает преподаватель). Отчет по работе оформляют в соответствии с вышеприведенной схемой. Полученный результат сдают преподавателю и рассчитывают величину относительной ошибки (см. предыдущую работу). |
Нижний мениск жидкости должен совпадать с меткой на колбе. Мерную пипетку промыть раствором задачи. Последние капли жидкости из пипетки не вытряхивать.
Бюретку промыть раствором титранта, удалить воздух из носика. С воронкой не титровать! Результаты параллельных титрований не должны различаться между собой более чем на 0,05 мл, в противном случае число титрований увеличивают. |
Вопросы для контроля усвоения темы:
В чем состоит сущность методов кислотно-основного титрования?
Какие растворы применяют в качестве титрантов в ациди– и в алкалиметрии?
Какие стандартные вещества используют для установки точной концентрации раствора HCl и раствора NaOH? Перечислите требования к установочным веществам.
Выведите формулу, по которой вычисляют объем концентрированного раствора HCl известной плотности, необходимой для приготовления более разбавленного раствора с известной концентрацией.
В чем заключается сущность титрования по методу аликвотных проб и методу отдельных навесок?
Дайте определение титра раствора.
Приведите примеры индикаторов кислотно-основного титрования. В чем сущность ионной и ионно-хромофорной теорий индикаторов?
Как выбрать индикатор? Предложите индикаторы для титрования раствором HCl оснований: NaOH, NH3, диэтиламин, Ba(OH)2, и раствором KOH кислот: CH3COOH, H2SO4, HF, HBr.
Рассчитайте молярную массу эквивалента тетрабората натрия, щавелевой кислоты, янтарной кислоты, карбоната натрия.
10.Выведите формулу для расчета массовой доли аммиака в навеске
хлорида аммония (g) методом замещения, если титрование
проводят способом аликвотных проб.
11.С какой целью бюретку перед титрованием ополаскивают
раствором титранта?
12.Можно ли ополаскивать колбы для титрования:
а) отбираемым в них раствором?
б) водой?
Надо ли сушить их перед титрованием?
13. Как рассчитать поправочный коэффициент?
14. В чем сущность прямого, обратного и заместительного
титрования?
15. Что понимают под точкой эквивалентности?
16. Приведите формулу расчета титра соответствия вещества А по
веществу В.
17. Перечислите последовательность операций при определении
массовой доли аммиака в солях аммониях методом замещения.
Какие реакции при этом протекают?
18.Приведите примеры веществ, не обладающих свойствами кислот
и оснований, которые можно определить методами кислотно-
основного титрования.
19.Приведите примеры применения метода кислотно-основного
титрования в фармации.
X. Перечень практических навыков.
Уметь:
Брать навеску вещества на аптечных и на аналитических весах.
Отмеривать объем раствора пипеткой.
Готовить раствор в мерной колбе.
Проводить титрование из бюретки.
Проводить количественное определение методами ациди- и алкалиметрии.
Рассчитывать результаты титриметрических определений.
Задания по теме «Кислотно-основное титрование», выносимые для проверки практических навыков.
Установить поправочный коэффициент и титр ~ 0,1 н. раствора едкого натра по щавелевой кислоте. Определение провести способами аликвотных проб и отдельных навесок.
Определить содержание карбоната натрия в образце кристаллогидрата Na2CO3·10H2O (в % масс.) методом ацидиметрии. Титрование провести методом аликвотных проб.
Определить содержание щавелевой кислоты в техническом продукте (в % масс.) методом алкалиметрии. Титрование провести методом аликвотных проб.
Установить поправочный коэффициент и титр ~ 0,1 н. HCl по карбонату натрия. Титрование провести способами аликвотных проб и отдельных навесок.
Установить поправочный коэффициент ~ 0,1 н. HCl по тетраборату натрия. Титрование провести способами аликвотных проб и отдельных навесок.
Определить массовую долю аммиака в образце хлорида аммония. Титрование провести способом аликвотных проб.
Приложение:
Примерный вариант задания к зачету для проверки практических навыков.
Установить поправочный коэффициент и титр ~ 0,1 н. HCl по карбонату натрия. Титрование провести способом аликвотных проб.
Посуда: Мерная бюретка 0 – 25 мл, мерная колба 100 мл, мерная пипетка 10 мл, конические колбы для титрования.
Реактивы: 0,1 н. раствор HCl, Na2CO3, х. ч, раствор индикатора – метилоранжа.
На титрование аликвотной пробы раствора Na2CO3 должно расходоваться около 15 мл ~ 0,1 н. раствора HCl.








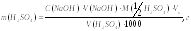 где
С(NaOH)
– молярная концентрация эквивалента
раствора щелочи.
где
С(NaOH)
– молярная концентрация эквивалента
раствора щелочи.
