
- •Аминопроизводные ароматических кислот аминобензойные кислоты и их производные Производные п-аминобензойной кислоты
- •Производные п-аминобензойной кислоты (пабк)
- •Фп Бензокаин (Анестезин)
- •Подлинность
- •Чистота
- •Количественное определение
- •Основными условиями титрования, гарантирующими количественное протекание этой реакции, являются:
- •Фп гф хii 42-0265-07 Новокаина гидрохлорид (Новокаин) Novocainum (лн) Прокаина гидрохлорид Procaine hydrochloride (мнн)
- •Получение
- •Подлинность
- •2.Реакции окисления по ароматической аминогруппе:
- •Количественное определение
- •Тетракаина гидрохлорид (фп Дикаин)
- •Подлинность
- •Чистота
- •Количественное определение
- •Производные амида п-аминобензойной кислоты Прокаинамида гидрохлорид (фп Новокаинамид )
- •Подлинность
- •Реакции подлинности
- •Количественное определение
- •Нефармакопейные
- •Производные диэтиламиноацетанилида
- •Получение
- •Описание
- •Химические свойства
- •Подлинность
- •Реакции подлинности
- •Чистота
- •Количественное определение
- •Применение
- •Формы выпуска
Получение
Исходным продуктом для лидокаина является 2,6-диметиланилин, а для тримекаина - 2,4,6-триметиланилин. Синтез осуществляют по схеме:
O
Cl–CH2–C
Cl
Хлорангидрид
монохлор уксусной кислоты
- HCl(конденсация)
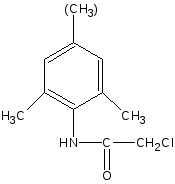

C2H5 NH
• HCl
C2H5
- HCl
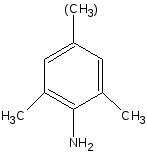



2,6-диметиланилин
(2,4,6-триметиланилин)
2,4-диметилхлорацетанилид
(2,4,6-триметилхлорацетанилид
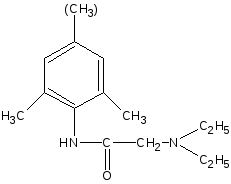
• HCl
лидокаин (тримекаин)
Описание
Тримекаина и лидокаина гидрохлориды представляют собой белые или с желтоватым оттенком кристаллические вещества, очень легко растворимые в воде, легко растворимы в этаноле и хлороформе, практически нерастворимы в эфире.
Химические свойства
Наличие амидной группы обусловливает свойства веществ вступать в реакции:
А) гидролиза под действием кислот и щелочей с образованием исходных веществ

аминосоединения 2,4- или (2,4,6)-замещенного анилина, (содержит первичную ароматическую аминогруппу, вступает в реакцию образования азакрасителя – диазотирования с последующим азосочетанием, даёт все реакции на ПААГ) и диэтиламиноуксусной кислоты
Б) «гидроксамовой пробы»
В) образовывать окрашенные осадки с солями металлов в щелочной среде после гидролиза.
Наличие третичного атома азота органических оснований (третичная алифатическая аминогруппа) определяет основные свойства препаратов и способность вступать в реакции солеобразования и комплексообразования.
Оба препарата применяются в виде солей хлороводородной кислоты.
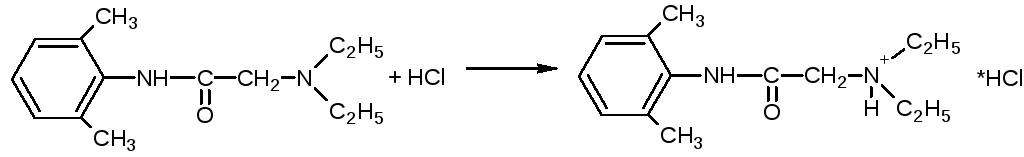
Лидокаин и тримекаин являются солями, образованными слабыми органическими основаниями и сильной кислотой, поэтому при действии щелочей легко выделяют в виде осадков свободные органические основания.
Подлинность
Тримекаина гидрохлорид
1. ИК-спектр в/вазелиновом масле в области от 4000 до 700 см-1 и сравнивают со спектром стандартного образца.
2. ВЭЖХ по времени удерживания (около 6 минут).
3.Т°пл
Лидокаина гидрохлорид
1.УФ-спектр водно-спиртового раствора вещества в области 250-300 им, который должен иметь максимумы поглощения при 262,5 нм и 271 нм и минимум поглощения при 255 нм.
2. ГЖХ. Испытание проводят при температуре детектора и испарителя 290 о (газ носитель - азот) в аналитической колонке, заполненной инертоном с неподвижной фазой.
3.Т°пл.
Реакции подлинности
1.ФС Лекарственные вещества дают реакцию на хлорид-ион:
R· НCl + АgNОз → R·НNОз + AgCl↓
2.ФС
Реакция гидролитического расщепления
с растворами щелочей или кислот,
вследствие которой образуются
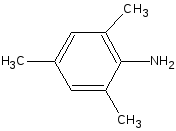
2,6-диметиланилин
(лидокаина гидрохлорид) или
2,4,6-триметиланилин
(тримекаина
гидрохлорид). Последние вступают в
реакции диазотирования и образования
азокрасителя:
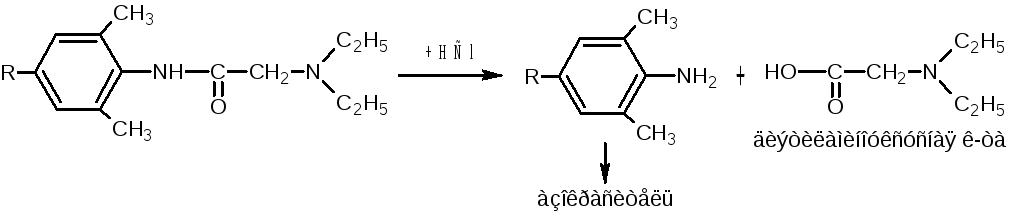
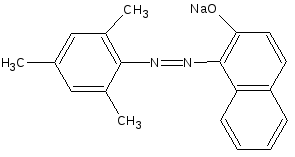
![]()
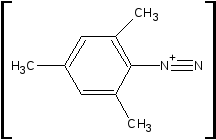
NaNO2
+ 2HCl
- NaCl;
- 2H2O
Cl-
(NaOH)


3.ФС Реакция отличия тримекаина гидрохлорида от других местноанестезирующих средств (на третичный амин)- комплексообразование. На предметном стекле препарат с 0,1 М раствором K2Cr2О7 и H2SО4 разв. образует со временем кристаллы в виде игл, собранные в пучки или веточки (микрокристаллическая реакция):
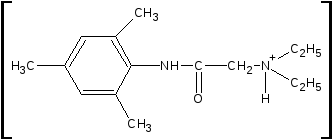
 •Cr2O72-
•Cr2O72-
2
4.Лидокаина гидрохлорид с пикриновой кислотой (на третичный амин - комплексообразование) образует пикрат лидокаина, у которого определяют температуру плавления (около 230 ОС):
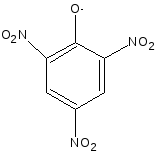
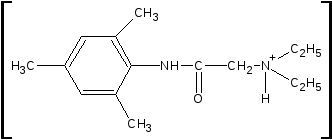
•
5.Реакция отличия тримекаина гидрохлорида от других местноанестезирующих средств. Окисление тримекаина гидрохлорида при температуре 155-156 оС в смеси меди (II) сульфата и концентрированной серной кислоты. После охлаждения смеси и нейтрализации конц. раствором аммиака появляется синее окрашивание, а при УФ-облучении наблюдается красно-розовая флюоресценция.
6. Реакция солеобразования с солями меди (II) и кобальта.
Тримекаина гидрохлорид взбалтывают со щелочью до растворения выделившегося основания, затем прибавляют раствор ацетата меди (II); образуется зелёное окрашивание.
Лидокаина гидрохлорид действием щелочи переводят в основание, растворяют в этаноле и прибавляют раствор кобальта хлорида; образуется синевато-зелёный осадок.
+ NaOH •
HCl
- NaCl
-
H2O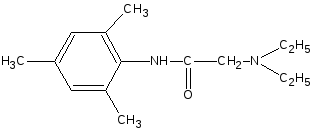
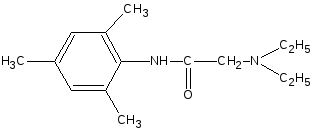
NaOH
- H2O

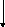
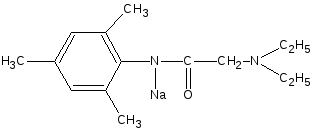
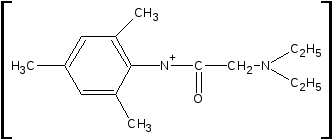
Cu2+

2Cu2+
