
- •ПРЕДИСЛОВИЕ
- •ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
- •Модуль 1. СТРОЕНИЕ ВЕЩЕСТВА, ХИМИЯ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- •Работа 1. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Работа 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА ОБЪЕМНЫМ МЕТОДОМ
- •Работа 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •Работа 4. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ
- •Работа 5. ХИМИЧЕСКИЕ СВОЙСТВА d-МЕТАЛЛОВ (Mn, Cu, Fe, Со)
- •Работа 6. ХИМИЧЕСКИЕ СВОЙСТВА р-ЭЛЕМЕНТОВ (Al, Sn, Pb)
- •Модуль 2. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
- •Работа 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •Работа 8. КИНЕТИКА ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- •Работа 9. КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- •Модуль 3. ХИМИЧЕСКИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В РАСТВОРАХ
- •Работа 10. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
- •Работа 11. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Работа 12. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •Работа 13. ЭЛЕКТРОЛИЗ
- •Работа 14. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •ЛИТЕРАТУРА
- •Содержание
6.Возможно ли взаимодействие между оксидами: Li2O и SO3; Na2O и BeO; Al2O3 и K2O; BaO и MgO; N2O5 и ZnO? Дайте обоснованный ответ и приведите уравнения соответствующих реакций.
7.Какие свойства гидроксидов NaOH, Al(OH)3, Ni(OH)2 могут быть использованы для их разделения из твердой смеси?
Работа 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА ОБЪЕМНЫМ МЕТОДОМ
Цель работы — усвоение понятий эквивалента, молярной массы эквивалента, способов расчета молярных масс эквивалентов веществ; экспериментальное определение эквивалента неизвестного металла объемным методом.
Теоретическая часть
Количественные расчеты в химии основаны на законе сохранения массы (М.В. Ломоносов, 1756; Лавуазье, 1785): масса реагентов равна массе продуктов реакции. Для определения количеств образующихся продуктов реакции при известном количестве реагентов необходимо составить полное уравнение реакции с коэффициентами.
Немецкие химики Венцель и Рихтер сформулировали закон эквивалентов (1793): вещества реагируют и образуются в эквивалентных количествах, что позволяет производить вычисления без составления полного уравнения реакции.
За единицу эквивалента принят 1 моль атомарного водорода, молярная масса которого равна 1 г/моль (точнее, 1,00794 г/моль). Эквиваленты других веществ определяются количеством вещества, которое в химических реакциях равноценно (соединяется или замещается) 1 молю атомарного водорода или 1 электрону в окис- лительно-восстановительных реакциях.
Число, показывающее, какая доля моля вещества эквивалентна в реакции одному атому водорода или одному электрону, называют фактором эквивалентности f.
Фактор эквивалентности обратен числу эквивалентности Z, которое численно равно абсолютному значению степени окисления
14
иона или числу электронов, переданному восстановителем окислителю или принятому окислителем от восстановителя: f = 1/Z.
Молярная масса эквивалента Mэкв в Z раз меньше соответствующей молярной массы вещества M, участвующего в реакции:
|
|
М |
|
Mэкв |
= |
|
= fM . |
|
|||
|
|
Z |
|
Рассмотрим количественные отношения веществ в реакции нейтрализации:
|
H2SO4 |
+ 2NaOH |
→ Na2SO4 + |
|
2H2O |
|||||||
Молярные ко- |
1 моль |
|
2 моль |
|
1 моль |
|
2 моль |
|||||
личества ве- |
|
|
|
|
|
|
|
|
|
|
|
|
ществ |
|
|
|
|
|
|
|
|
|
|
|
|
Фактор эквива- |
1/2 |
1 |
1/2 |
1 |
||||||||
лентности |
|
|
|
|
|
|
|
|
|
|
|
|
Число эквива- |
2 |
1 |
2 |
1 |
||||||||
лентности Z |
|
|
|
|
|
|
|
|
|
|
|
|
Эквивалентные |
2 моль |
|
2 моль |
|
2 моль |
|
2 моль |
|||||
количества ве- |
|
|
|
|
|
|
|
|
|
|
|
|
ществ (моль |
|
|
|
|
|
|
|
|
|
|
|
|
эквивлентов) |
|
|
|
|
|
|
|
|
|
|
|
|
Молярные мас- |
98 |
= 49 |
40 |
= 40 |
142 |
= 71 |
18 |
= 18 |
||||
сы эквивалентов |
|
|
|
|
|
|
|
|||||
2 |
1 |
2 |
1 |
|||||||||
|
|
|
|
|||||||||
веществ |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||
(г/моль)
Эквивалент вещества не является постоянной величиной, его рассчитывают для каждой реакции, в которой участвует это вещество.
Приведем примеры расчетов.
1. Определение числа эквивалентности и молярных масс эквивалентов веществ, участвующих в реакциях обмена:
а) для кислоты число эквивалентности определяется количеством ионов водорода, которые замещаются ионами металла, т. е.
основностью кислоты:
H3PO4 |
+ NaOH → NaH2PO4 |
+ H2O; Zк = 1; Мэкв.к = |
М |
≈ 98 г/моль; |
|
||||
|
|
1 |
|
|
15

H3PO4 + 2NaOH → Na2HPO4 |
+ 2H2O; Zк = 2; Мэкв.к = |
|
М |
≈ 49 г/моль; |
||
|
|
|||||
|
|
2 |
|
|||
H3PO4 |
+ 3NaOH → Na3PO4 + 3H2O; Zк = 3; Мэкв.к = |
М |
≈ 32,67 г/моль; |
|||
|
||||||
|
|
3 |
|
|
|
|
б) для основания число эквивалентности определяется количеством гидроксид-ионов, которые замещаются анионами кислоты, т. е. кислотностью основания:
Al(OH)3 |
+ HCl → Al(OH)2Cl + H2O; Zосн = 1; Мэкв.осн = |
М |
≈ 78 г/моль; |
|
|||
|
1 |
|
|
Al(OH)3 + 2HCl → Al(OH)Cl2 + 2H2O; Zосн = 2; Мэкв.осн = М ≈ 39 г/моль;
2
Al(OH)3 + 3HCl → Al(OH)3 + 3H2O; Zосн = 3; Мэкв.осн = М ≈ 26 г/моль;
3
в) для соли число эквивалентности определяется произведением степени окисления катиона (или аниона по модулю) n на количество ионов m, Z = nm:
NaCl: Z = 1·1 = 1; Мэкв = М ≈ 58,5 г/моль
Na2SO4: Z = 1·2 = 2; Мэкв = 1/2М ≈ 71,0 г/моль
Al2(SO4)3: Z = 3·2 = 6; Mэкв= 1/6M ≈ 192 г/моль
2. Определение числа эквивалентности и молярных масс эквивалентов окислителя и восстановителя в окислительновосстановительных реакциях.
Число эквивалентности окислителя и восстановителя в окисли- тельно-восстановительной реакции определяется количеством принятых или отданных электронов.
Для реакции
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + H2O
восстановитель
SO32− – 2e + H2O → SO24− + 2H+ Z = 2;
Мэкв.восст = |
M |
= |
80 |
= 40 г/моль; |
|
|
|||
|
Z |
2 |
|
|
16
окислитель:
MnO−4 + 5e + 8H +→Mn2+ + 4H2O Z = 5;
Мэкв.окисл = |
M |
|
119 |
= 23,8 г/моль. |
|
|
= |
|
|
||
Z |
5 |
||||
Экспериментально эквивалент простого вещества может быть определен по количеству замещаемого водорода либо присоединяемого кислорода, или другого элемента, эквивалент которого известен. Эквивалент можно определить электрохимическим путем на основании закона Фарадея, согласно которому при прохождении заряда 96 484 Кл через раствор электролита на электродах превращается один эквивалент вещества.
В данной работе использован способ определения эквивалента активного металла, основанный на измерении объема водорода, выделяющегося при растворении металла в соляной кислоте:
Me + nHCl → MeCln + n/2H2
Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль.
Используя закон Авогадро, можно определить объем, который занимает один моль эквивалентов водорода при определенных физических условиях. При нормальных физических условиях (н.у.,
р = 1,013·105 Па, или р = 760 мм рт. ст., Т = 273 K) 1 моль водорода, имеющий массу 2 г/моль, занимает объем V = 22,4 л, тогда 1 моль эквивалентов водорода, имеющий массу 1 г/моль, должен занимать объем Vэкв H2 = 11,2 л.
Таким способом можно рассчитать объем, занимаемый одним эквивалентом любого газа. Например, для O2 эквивалентный объем равен Vэкв H2 = 5,6 л (н.у.), поскольку молярная масса эквивален-
та кислорода равна 8 г/моль и составляет 1/4 его молярного объема; для хлороводорода 1 моль эквивалентов занимает объем Vэкв HCl = 22,4 л (н.у.), так как молярная масса его эквивалента равна молярной массе (Z = 1).
17
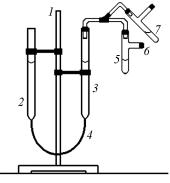
Практическая часть
Молярную массу эквивалента металла определяют с помощью прибора, называемого эвдиометром (рис. 2.1). Прибор состоит из штатива 1, на котором закреплены бюретки 2 и 3, соединенные шлангом 4. Бюретки имеют поперечное сечение 1 см2 и градуированы с точностью 0,1 см, причем нулевая отметка находится в верх-
ней части бюретки.
К бюретке 3 присоединена пробирка 5 с отводной трубкой 6. Бюретки заполнены водой, пробирка 5 — концентрированной соляной кислотой. В отводную трубку помещают образец металла с известной массой. Загрузив металл, прибор проверяют на герметичность, поднимая и опуская бю-
Рис. 2.1. Эвдиометр ретку 2 относительно бюретки 3, в которой уровень воды при этом будет колебаться, но не стремиться к выравниванию с уровнем в
бюретке 2. После проверки прибора на герметичность уравнивают положение уровней воды в обеих бюретках и отмечают положение уровня в бюретке 3 по нижнему мениску, записывая его значение по градуировочной шкале h1 с точностью 0,1 см.
Затем осторожно сбрасывают металл в кислоту, переводя пробирку 5 из положения 6 в положение 7. В процессе растворения металла бюретку 2 опускают таким образом, чтобы уровни воды в бюретках не слишком различались. По окончании процесса растворения металла в кислоте точно выравнивают положение уровней в обеих бюретках и записывают новое положение уровня h2 в бюретке 3.
Объем выделившегося водорода V в реакции равен разности уровней V = h2 – h1, измеряется в кубических сантиметрах (миллилитрах) и относится к атмосферным условиям ( p, T) проведения опыта.
В соответствии с законом эквивалентов эквивалент металла Эмет, имеющий молярную массу Мэкв, вытесняет эквивалент водо-
18
рода ЭН, который при нормальных условиях занимает объем Vэкв = = 11 200 см3, а используемая в опыте масса металла m вытесняет объем водорода V0, приведенный к нормальным условиям:
|
Mэкв |
|
Vэкв |
|
(2.1) |
|
|
= |
. |
||
|
m |
V0 |
|
||
Объем водорода, измеренный при |
атмосферных условиях |
||||
( p, T), пересчитывают на нормальные условия по уравнению Клапейрона:
pV |
p0 V0 |
(2.2) |
||
|
= |
|
|
|
|
, |
|||
TT0
вкотором значения p0, V0, T0 относятся к нормальным условиям, а p, V, T — к условиям проведения опыта. Давление p газов в бюретке 3 в соответствии с законом Дальтона будет равно сумме парциальных давлений воздуха pвозд, водорода pн и насыщенного водяно-
го пара pпар:
p = pвозд + pн + pпар. |
(2.3) |
Давлением водорода ввиду незначительности его объема можно пренебречь, а давление водяного пара нужно учесть.
При одинаковом положении уровней воды в обеих бюретках давление в бюретке (2.3) будет меньше атмосферного на величину давления насыщенного водяного пара, которое зависит только от температуры (табл. 2.1):
p = pатм – pпар.
Решая уравнение (2.2) относительно V0 и подставляя это решение в (2.1), получаем уравнение для расчета молярной массы эквивалента металла Мэкв:
Mэкв = |
mVэкв |
mVэкв p0T |
(2.4) |
||
|
= |
|
|
||
|
. |
||||
|
V0 |
pVT0 |
|
||
Преобразуем уравнение (2.4), подставив известные числовые данные:
|
|
m 11 200 p0 |
(273 + t) |
|
|
Mэкв |
= |
|
|
. |
(2.5) |
|
|
||||
|
|
( pатм − pпар )V 273 |
|
||
19
Таблица 2.1
Зависимость давления насыщенного водяного пара от температуры
t, °С |
р, Па |
р, мм рт. ст. |
t, °С |
р, Па |
р, мм рт. ст. |
15 |
1705,1 |
12,79 |
23 |
2809,0 |
21,07 |
16 |
1817,1 |
13,63 |
24 |
2983,7 |
22,38 |
17 |
1947,1 |
14,53 |
25 |
3167,2 |
23,76 |
18 |
2063,8 |
15,48 |
26 |
3361,0 |
25,21 |
19 |
2197,1 |
16,48 |
27 |
3564,9 |
26,74 |
20 |
2337,8 |
17,53 |
28 |
3779,6 |
28,35 |
21 |
2486,4 |
18,65 |
29 |
4004,9 |
30,04 |
22 |
2643,7 |
19,83 |
30 |
4242,2 |
31,82 |
|
|
|
|
|
|
Рассчитав молярную массу эквивалента металла по уравнению (2.3), можно определить металл путем подбора значения его молярной массы M = Mэкв.экспZ, задавая, например, три последовательных значения Z, равные 1, 2 и 3.
В Периодической системе элементов Д.И. Менделеева выбираем металл, проявляющий соответствующую валентность Z, для которого расхождение расчетного значения молярной массы с табличной не превышает 1…2 г/моль. Затем рассчитываем относительную погрешность опыта по уравнению
M = Мэкв.табл − Мэкв.эксп 100 %,
Мэкв.табл
где Мэкв.эксп — молярная масса эквивалента металла, рассчитанная из опытных данных по уравнению (2.5); Мэкв.табл — теоретическая молярная масса эквивалента металла, рассчитанная по уравнению
Мэкв.табл = Мтабл / Z.
Полученные результаты внесите в табл. 2.2.
20
|
|
|
|
|
|
|
|
Таблица 2.2 |
|
|
|
Экспериментальные данные |
|
|
|||
|
|
|
|
|
|
|
|
|
Опыт |
m, г |
|
hн, мл |
hк, мл |
V = hк – hн, мл |
|
pатм |
pпар |
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
Опыт |
p = pатм |
– pпар |
T, K |
Mэкв.эксп, |
|
Mэкв.теор, |
M, % |
|
г/моль |
|
г/моль |
||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
Вопросы для подготовки к защите лабораторной работы
1. Укажите, в каких соединениях молярная масса эквивалента составляет половину его молярной массы: CO2, Ca(OH)2, Na2HPO4, KHS, K2Cr2O7, K2CrO4.
2.Вычислите молярную массу эквивалента следующих восстановителей: а) хлорида олова (II), окисляющегося до хлорида олова (IV); б) элементарного фосфора, окисляющегося до H3PO4; в) пероксида водорода, окисляющегося до молекулярного кислорода.
3.При взаимодействии ортофосфорной кислоты H3PO4 с гидроксидом калия образовалась кислая соль — дигидрофосфат калия. Напишите уравнение реакции, определите число эквивалентности и молярную массу эквивалента щелочи, кислоты и соли в данной реакции.
4.В промышленности многие металлы получают путем воздействия водорода на их соединения. Вычислите массу эквивалента металла и его оксида, если при восстановлении оксида металла массой 1,2 г водородом образовалась вода массой 0,27 г. Назовите этот металл, если его валентность равна двум.
5.Вычислите молярную массу эквивалента серной кислоты в следующих реакциях:
а) Zn + H2SO4(разб) → ZnSO4 + H2
б) 2HBr + H2SO4(конц) → Br2 + SO2 + 2H2O в) 8HI + H2SO4(конц) → 4I2 + H2S + 4H2O
21
