
- •ПРЕДИСЛОВИЕ
- •ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
- •Модуль 1. СТРОЕНИЕ ВЕЩЕСТВА, ХИМИЯ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- •Работа 1. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Работа 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА ОБЪЕМНЫМ МЕТОДОМ
- •Работа 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •Работа 4. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ
- •Работа 5. ХИМИЧЕСКИЕ СВОЙСТВА d-МЕТАЛЛОВ (Mn, Cu, Fe, Со)
- •Работа 6. ХИМИЧЕСКИЕ СВОЙСТВА р-ЭЛЕМЕНТОВ (Al, Sn, Pb)
- •Модуль 2. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
- •Работа 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •Работа 8. КИНЕТИКА ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- •Работа 9. КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- •Модуль 3. ХИМИЧЕСКИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В РАСТВОРАХ
- •Работа 10. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
- •Работа 11. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Работа 12. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •Работа 13. ЭЛЕКТРОЛИЗ
- •Работа 14. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •ЛИТЕРАТУРА
- •Содержание
Вопросы для подготовки и защиты лабораторной работы
1.Угольная кислота диссоциирует преимущественно по первой
ступени. Концентрация ионов водорода в 0,005 М растворе равна 4,25·10–5 моль/л. Оцените значение константы диссоциации Н2СО3 по первой ступени.
2.Какова концентрация ионов CN– в 1 л 0,01 н раствора HCN, в котором еще содержится 0,5 моль HBr? Кажущаяся степень диссо-
циации бромистоводородной кислоты равна 89,8 %. Константа диссоциации HCN Ka = 4,9 ·10–10.
3. Нижний предел бактерицидного действия серебра оценивается концентрацией его в растворе порядка 10–6 мг/л. Определите, достаточно ли серебра в насыщенном растворе AgCl для его бактерицидного действия. Произведение растворимости ПРAgCl =
=1,8·10–10.
4.Определите рН раствора, в 1 л которого содержится 0,1 г NaOH. Диссоциацию основания считайте полной.
5.Рассчитайте, во сколько раз концентрация ионов водорода в
крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
6.Выпадет ли осадок CaSO4, если смешать равные объемы 0,2 н растворов CaCl2 и Na2SO4? Известно, что ПРCaSO4 = 6,0 ·10–5.
7.Определите константу гидролиза и рН 0,01 н раствора KNO2. Константа диссоциации KNO2 Kа = 4,0 ·10–4.
Работа 12. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Цель работы — экспериментальное определение ЭДС гальванического элемента, расчет электродных потенциалов и изменения стандартной энергии Гиббса реакций, протекающих в гальванических элементах
Теоретическая часть
Гальванический элемент — это устройство, в котором энергия окислительно-восстановительной реакции превращается в элек-
92
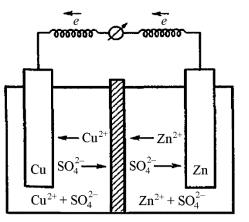
трическую. Простейший гальванический элемент представляет собой систему из двух находящихся в контакте металлических электродов, помещенных в растворы электролитов собственных ионов. Растворы разделяются пористой перегородкой (мембраной) или электролитическим мостиком, заполненным насыщенным раствором электролита.
Один из первых гальванических элементов — элемент Даниэля — Якоби (1836), состоящий из медного и цинкового электродов, погруженных в растворы собственных солей (рис. 12.1, 12.2).
Рис. 12.1. Схема элемента Даниэля — Якоби с пористой диафрагмой, разделяющей растворы
Условно гальванический элемент записывают, обозначая слева анод, справа — катод, в виде
Анод (–) Zn | Zn2+ || Cu2+ | Cu (+) Катод
или
Анод (–) Cu, Zn | Zn2+ || Cu2+ | Cu (+) Катод
Сплошной вертикальной линией обозначают границу раздела электрод—раствор, двумя вертикальными — границу раздела растворов.
93
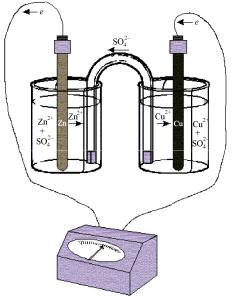
Рис. 12.2. Элемент Даниэля — Якоби с электролитическим мостиком
При замыкании электродов металлическим проводником происходит перенос электронов во внешней цепи и ионов в растворе, на электродах протекают полуреакции окисления и восстановления:
Aнод (–) (Zn): Zn Zn2+ + 2e
Катод (+) (Cu): Cu2+ + 2 e Cu
Токообразующая реакция имеет вид
Zn + Cu2+ → Zn2+ + Cu
Наибольшую разность потенциалов гальванического элемента, определяемую при обратимых условиях его работы, называют
электродвижущей силой элемента (ЭДС) и обозначают Е.
ЭДС равна сумме скачков потенциалов, возникающих на межфазных границах:
Е = ϕконт + ϕ– + ϕдиф + ϕ+,
94

— контактная разность потенциалов, возникающая на границе раздела металлов, для ее уменьшения используют одинаковые металлы; ϕ– и ϕ+ — потенциалы, возникающие на границе металл—электролит; ϕдиф — диффузионный потенциал, возникающий на границе двух электролитов, различающихся по составу или концентрации.
Значения диффузионного потенциала невелики и при использовании электролитического мостика практически сводятся к нулю. Поэтому ЭДС записывают как разность электродных потенциалов катода и анода:
E =ϕк −ϕа .
Для равновесного обратимого самопроизвольно протекающего процесса при постоянных температуре и давлении уменьшение
энергии Гиббса rGT0 равно максимальной полезной работе (второй закон термодинамики) Wmax, которая эквивалентна электрической энергии ZFE, получаемой при работе гальванического элемента:
− rGT0 = Wmax = ZFE, |
(12.1) |
где Z — число электронов, участвующих в реакции; F — константа Фарадея, F = 96485 Кл/моль.
Из уравнения (12.1) получим выражение для ЭДС гальванического элемента:
E = − rGT0 . ZF
ЭДС можно рассчитать, используя уравнение изотермы химической реакции:
rGT = −RT ln Ka + RT ln Π, |
(12.2) |
где Kа — константа равновесия окислительно-восстановительной реакции, протекающей в гальваническом элементе; П — отношение произведения неравновесных активностей продуктов реакции к произведению неравновесных активностей реагентов.
Для реакции, записанной в общем виде как
ARed + BOx AOx + BRed
95
уравнение (12.2) представим как
r GT |
= −RT ln Ka |
+ RT ln |
aA.Ox aB.Red |
, |
(12.3) |
|
|||||
|
|
|
aA.Red aB.Ox |
|
|
где aOx — активность окисленной формы вещества; aRed — активность восстановленной формы вещества.
Подставив выражение для энергии Гиббса из формулы (12.3) в (12.2), получим
E =− |
r GT |
= |
RT |
ln Ka |
+ |
RT |
ln |
aA.Ox aB.Red |
. |
(12.4) |
|
|
|
|
|||||||
|
ZF |
|
ZF |
|
ZF aA.Red aB.Ox |
|
||||
При постоянной температуре первый член уравнения (12.4) постоянен и представляет собой стандартную ЭДС:
E0 = |
RT |
ln Ka =ϕOx0 −ϕ0Red =ϕк0 −ϕ0а . |
(12.5) |
|
|||
|
ZF |
|
|
Уравнение (12.4) с учетом уравнения (12.5) запишем в виде
E = E0 − |
RT |
ln |
aA.Ox aB.Red |
. |
(12.6) |
|
|
||||
|
ZF aA.Red aB.Ox |
|
|||
Выражение (12.6) является уравнением Нернста для ЭДС гальванического элемента, из которого можно получить уравнение для электродного потенциала следующим способом.
Заменим знак «минус» перед вторым членом на «плюс», для чего под знаком логарифма поменяем местами числитель и знаменатель, и разделим катодные и анодные процессы.Получим:
|
|
|
RT |
|
a |
|
|
|
|
RT |
|
a |
|
E = |
ϕOx0 |
+ |
|
ln |
B.Ox |
|
− |
ϕ0Red |
+ |
|
ln |
A.Ox |
. |
|
|
|
|
||||||||||
|
|
|
ZF |
|
aB.Red |
|
|
|
ZF |
|
aA.Red |
||
Уравнение Нернста для электродного потенциала имеет вид
ϕ |
|
|
|
=ϕ0 |
|
|
0 + |
RT |
ln |
aOx |
. |
(12.7) |
z + |
/M |
0 |
z + |
/M |
|
|
||||||
M |
|
|
M |
|
|
ZF |
aRed |
|
||||
|
|
|
|
|
|
|
|
|
||||
Приняв активность восстановленной формы вещества постоянной величиной, равной единице, заменив R, F их значениями,
96
перейдя от натурального логарифма к десятичному, для температуры T = 298 K уравнение (12.7) представим в виде
ϕ |
|
|
|
= ϕ |
0 |
|
|
0 + |
8, 31 298 |
2,3lg |
aOx |
= ϕ |
0 |
|
|
0 + |
0, 059 |
lg ai |
, (12.8) |
z + |
/M |
0 |
M |
z + |
/M |
|
|
M |
z + |
/M |
|
||||||||
M |
|
|
|
|
|
Z 96487 |
1 |
|
|
|
Z |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
где ai — активность иона.
Уравнение (12.8) используют для расчета потенциала электрода, в разбавленных растворах электролитов вместо активности ионов можно использовать их молярные концентрации.
Абсолютное значение электродного потенциала экспериментально определить нельзя, поэтому находят условные величины, характеризующие потенциалы электродов по отношению к электродам сравнения, значения потенциалов которых приняты в качестве стандартных.
Электроды сравнения должны быть обратимыми и иметь устойчивые во времени и хорошо воспроизводимые потенциалы.
При измерении ЭДС применяют каломельный, хлоридсеребряный, хингидронный и другие электроды сравнения. Значения электродных потенциалов металлов для водных растворов (при активностях ионов металлов в растворе, равных 1 моль/л и T = 298 K), определены относительно стандартного водородного электрода. Их значения приводятся в ряду стандартных электродных потенциалов.
Стандартный водородный электрод, потенциал которого условно принят равным нулю при любой температуре, состоит из платиновой пластины, покрытой мелкодисперсной платиной с высокой каталитической активностью. Пластина насыщается газообразным водородом под давлением в 1 атм в растворе Н2SO4 с активностью ионов водорода 1 моль/л, электродный процесс описывается уравнением
2H+ + 2e H2, |
ϕ0 |
+ |
/H |
= 0. |
|
2H |
|
2 |
Электродные потенциалы газовых электродов (водородный, кислородный и др.) зависят от активностей потенциалопределяющих ионов в растворе и от парциального давления газа.
Приняв парциальное давление водорода равным стандартному давлению и заменив активность ионов водорода величи-
97
ной рН, получим уравнение для расчета потенциала водородного электрода:
ϕ2H+ / H2 = −0, 059pH.
Электроды, которые состоят из инертного проводника, контактирующего с раствором, содержащим одновременно окисленную и восстановленную формы вещества, относятся к окислительновосстановительным, или редокс-электродам.
Для расчета окислительно-восстановительных электродных потенциалов применяют уравнение (12.7).
Концентрационные гальванические элементы состоят из одинаковых электродов, погруженных в одинаковые электролиты с разными активностями ионов, например:
(–) Cu | Cu2+(a1) || Cu2+(a2) | Cu (+), a2 > a1 Катод (Cu ) (+): Cu2+ + 2 e Cu
Aнод (Cu ) (–): Cu – 2e Cu2+
ЭДС концентрационных элементов позволяет определить некоторые физико-химические свойства электролитов, такие как активность и коэффициент активности, растворимость труднорастворимых соединений и др.
Практическая часть
Перед проведением измерений электроды необходимо зачистить наждачной бумагой, промыть дистиллированной водой, протереть фильтровальной бумагой.
Опыт 1. Зависимость ЭДС медно-цинкового гальванического элемента (Даниэля — Якоби) от концентрации раствора электролита
В два стаканчика налейте по 40 мл растворов, в один — 0,1 М CuSO4, в другой — 0,1 М ZnSO4. Опустите медный электрод в раствор CuSO4, цинковый — в раствор ZnSO4. Соедините растворы электролитическим мостиком, запишите экспериментальное значение ЭДС гальванического элемента, используя вольтметр.
98
Приведите условную схему гальванического элемента, напишите уравнения электродных процессов и токообразующей реакции. Рассчитайте по уравнению Нернста теоретические значения электродных потенциалов медного и цинкового электродов (активности ионов меди и цинка примите равными их концентрациям), ЭДС гальванического элемента и стандартную энергию Гиббса rG0 реакции.
Опыт 2. Измерение ЭДС концентрационного гальванического элемента
В два стаканчика налейте по 40 мл растворов, в один — 1 М CuSO4, в другой — 0,01 М CuSO4, опустите в растворы медные электроды. Соедините растворы электролитическим мостиком, измерьте вольтметром и запишите экспериментальное значение ЭДС концентрационного гальванического элемента.
Приведите условную схему гальванического элемента и уравнения электродных процессов.
Рассчитайте по уравнению Нернста (12.8) теоретические значения электродных потенциалов медных электродов (активности ионов меди примите равными их концентрациям), ЭДС концентрационного гальванического элемента и стандартную энергию Гиббса rG0 реакции.
Опыт 3. Измерение ЭДС окислительно-восстановитель- ного гальванического элемента
В опыте измеряется ЭДС гальванического элемента, в котором протекает окислительно-восстановительная реакция
K2Cr2O7 + 3Na2SO3 + 4Н2SO4 K2SO4 + Cr2(SO4)3 + 3Na2SO4 + 4Н2O
В один стаканчик налейте 40 мл раствора K2Cr2O7, прибавьте 10 капель раствора разбавленной Н2SO4 и 5 капель раствора Cr2(SO4)3. В другой стаканчик налейте 40 мл раствора Na2SO3 и прибавьте 5 капель раствора Na2SO4. Соедините растворы электролитическим мостиком, опустите в оба стаканчика графитовые электроды. Измерьте вольтметром и запишите экспериментальное значение ЭДС.
Приведите условную схему данного окислительно-восстанови- тельного гальванического элемента и уравнения полуреакций окисления и восстановления. Рассчитайте стандартную энергию Гиббса rG0 протекающей в гальваническом элементе реакции, используя экспериментальное значение ЭДС.
99
Вопросы для подготовки и защиты лабораторной работы
1.В каком направлении будут перемещаться электроны во внешней цепи, если гальванические элементы составлены из металлов: а) никеля и меди; б) свинца и серебра; в) марганца и цинка, погруженных в одномолярные растворы собственных ионов? Напишите уравнения электродных процессов.
2.Приведите пример концентрационного гальванического элемента. Как рассчитать его ЭДС?
3.Составьте схему гальванического элемента, напишите уравнения электродных процессов и токообразующей реакции, рассчитайте ЭДС элемента, у которого один электрод — алюминиевый, а второй — стандартный водородный. Примите активность ионов алюминия, равной 1 моль/л, температуру 298 K.
4.В гальваническом элементе Ni Ni2+ Cu2+ Cu активности ионов равны aNi2+ = 0,05 моль/л, aCu2+ = 0,01моль/л. Рассчитайте
изменение энергии Гиббса rG, работу W гальванического элемента и константу равновесия Ka при температуре Т =298 K.
5.Вычислите потенциал водородного электрода, погруженного
вводные растворы:
а) рН = 9; б) рН = 2; Т = 298 K.
6. В концентрационном гальваническом элементе
Pt Ag+ Ag+ Pt
активности ионов Ag+ равны а1 = 10–4 моль/л, а2 = 10–1 моль/л. Рассчитайте ЭДС элемента при температуре Т = 298 K, укажите анод
икатод.
7.ЭДС медно-цинкового элемента равна 0,89 В. Определите с помощью термодинамических расчетов, какая из ниже приведенных реакций является ЭДС-определяющей (энергии Гиббса обра-
зования участников реакции равны fG0ZnO = –318,4 кДж/моль; fG0CuO = –127,3 кДж/моль; fG0 = –146,5 кДж/моль):
Zn + CuО ZnО + Cu
Zn + Cu2О ZnО + 2Cu
Zn + 2CuО ZnО + Cu2О
100
