
35782
.pdf
Рис.12.1. К выводу уравнения диффузии.
потока вещества через единичную площадку в сечении x, а через j2 - плотность потока вещества в сечении (x+ x). И пусть x мало, а закон изменения концентрации носит монотонный характер, тогда приближенно характер изменения плотности потока на отрезке x можно принять линейным и записать
j1 = j2 − |
∂j |
|
x. |
(12.2) |
|
∂x |
|||||
|
j1 , входящего в объем |
x в единицу |
|||
Поскольку количество вещества |
|||||
времени, отлично от выходящего j2 из этого объема, то концентрация вещества в объеме изменяется во времени, т.е.
j1 − j2 |
= |
∂ρ |
x. |
(12.3) |
|
∂τ |
|||||
|
|
|
|
На основании закона сохранения вещества следует, что
|
∂ρ |
= − |
∂j |
|
|
(12.4) |
||
|
∂τ |
∂x |
|
|||||
|
|
|
|
|
||||
Поставим в (12.4) вместо j его значение из (12.1): |
|
|||||||
|
∂ρ |
|
∂ |
∂ρ |
(12.5) |
|||
|
∂τ |
= |
|
|
D |
|
||
|
|
|
||||||
|
|
∂x |
∂x |
|
||||
Если концентрация вещества изменяется в направлениях x, y, z, а D не зависит от координат, то уравнение (12.5) можно обобщить и представить в виде
∂ρ |
|
|
∂2 ρ |
+ |
∂2 |
ρ |
+ |
∂2 |
ρ |
= D 2 ρ. |
|
|
(12.6) |
||||
|
= D |
|
2 |
|
|
2 |
|
|
2 |
|
|
|
|||||
∂τ |
|
|
∂x |
|
∂y |
|
∂z |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Уравнение (12.6) в |
стационарном |
|
|
режиме |
∂ρ |
= 0 |
в прямоугольных, |
||||||||||
|
|
∂τ |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цилиндрических и сферических координатах для одномерных задач примет вид
111
∂2 ρ |
= 0; |
d 2 ρ |
+ |
1 dρ |
= 0; |
|
∂x2 |
dx2 |
x dx |
||||
|
|
|
d 2 ρ |
+ |
2 dρ |
= 0. |
(12.7) |
||
dx2 |
|
|
||||
x dx |
||||||
|
|
|
||||
12.2. Влажность
Рассмотрим основные понятия и определения.
В настоящее время изменение и регулирование влажности играет важную роль при проведении научных исследований и в промышленности. Приведем отдельные примеры, связанные с измерением, регулированием и расчетом влажностного режима в различных отраслях человеческой деятельности.
Прежде всего, влажность воздуха имеет большое гигиеническое значение, т.к. она влияет на интенсивность испарения влаги телом человека. Гигиенисты считают нормальной относительную влажность воздуха в пределах от 30 до 60%. Если влажность будет высокой, то это затрудняет отдачу влаги с поверхности, что неблагоприятно отражается на состоянии организма. При низкой влажности (менее 30%), наоборот, появляется усиленное испарение влаги с кожи и слизистых оболочек, неприятное ощущение сухости во рту и в горле.
Повышенная влажность помещений приводит к развитию грибков, плесени, гниению материалов. С влажностным режимом сооружений связана их долговечность. Измерение и регулирование влажности газовых сред составляет важную часть многих процессов, связанных с производством и хранением продуктов, сушкой материалов и изделий, кондиционированием воздуха в помещениях и т.д.
Разнообразные приборы часто работают в сложном тепловом и влажностном режимах, что может привести к выходу их из строя или нарушению точности показаний. Например, сложная оптическая система, переносимая из среды с низкой температурой в среду с более высокой температурой, находится в сложном динамическом тепловом и влажностном режиме. При определенных обстоятельствах на поверхностях оптической системы может неравномерно конденсироваться влага, которая приведет в конечном итоге к искажению изображения. Даже если влага в дальнейшем испарится, то она может оставить следы в виде пятен, существенно понижающих качества оптического прибора. В настоящее время при проектировании практически любого прибора задается диапазон изменения влажности, в котором прибор должен нормально функционировать.
Влажность. Рассмотрим обычный атмосферный воздух, в котором кроме постоянных газов, присутствуют в молекулярном состоянии пары воды, а также часть влаги в виде капель. Если рассматривать влажный воздух (в том числе и капли) как смесь идеальных газов, то для них справедлив закон Дальтона:
112

ЕСЛИ В ОДНОМ И ТОМ ЖЕ ОБЪЕМЕ ЗАКЛЮЧЕНЫ ДВА РАЗЛИЧНЫХ ГАЗА, ТО КАЖДЫЙ ИЗ НИХ ЗАПОЛНЯЕТ ВЕСЬ ОБЪЕМ, КАК ЕСЛИ БЫ ДРУГОГО ГАЗА НЕ БЫЛО. ДАВЛЕНИЕ ЛЮБОГО ИЗ ЭТИХ ГАЗОВ ЯВЛЯЕТСЯ ЕГО ПАРЦИАЛЬНЫМ ДАВЛЕНИЕМ, ОБЩЕЕ ДАВЛЕНИЕ РАВНО СУММЕ ПАРЦИАЛЬНЫХ; С МОЛЕКУЛЯРНОЙ ТОЧКИ ЗРЕНИЯ ЭТО ОЗНАЧАЕТ, ЧТО СРЕДИ МОЛЕКУЛ НЕТ СИЛ ПРИТЯЖЕНИЯ.
Парциальное давление P водяного пара обычно называют упругостью водяного пара и измеряют в миллиметрах ртутного столба.
Основными характеристиками влажного состояния газа являются абсолютная влажность и влагосодержание.
Абсолютная влажность. Количество влаги в килограммах, содержащееся в 1 м3 воздуха, называется его абсолютной влажностью mn (кг/ м3 ) . Чем больше mn , тем больше и парциальное давление Рn при тех
же температуре и барометрическом давлении воздуха. Следовательно, величина Р также является характеристикой его влажности. При фиксированных температуре и барометрическом давлении величина Рn не
может увеличиваться беспредельно за счет поступления извне и имеет предельное значение - Рнn -давление насыщенного пара; максимальному
значению Рп = Рнn соответствует и максимальное значение абсолютной влажности mнn .
Чем выше температура воздуха, тем больше значения Рнn и mнn .
Например, в табл.12.2 приведены значения упругости насыщенного водяного пара в миллиметрах ртутного столба для различных значений температур при барометрическом давлении 755 мм рт.ст.
Таблица 12.2
Упругость водяного пара Рn в воздухе или его абсолютная влажность mn не дают представления о степени насыщения влагой воздуха, если при
этом не указана его температура.
Относительная влажность. Чтобы выразить степень насыщения воздуха влагой, вводится понятие относительной влажности. Относительная влажность выражается в процентах и равна отношению
113
действительной массы mn пара в объеме к максимально возможной массе mпв пара при данной температуре:
ϕ = |
mп |
100%. |
(12.8) |
|
|||
|
mнп |
|
|
Для лучшего уяснения понятия "относительная влажность" рассмотрим объем 1 м3 . В объеме находится вода, количество которой немного больше количества, необходимого для насыщения объема парами воды при температуре T. Пусть для простоты рассуждений в объеме нет постоянного газа (воздуха или азота), капельной фазы в объемах также нет. На основании уравнения состояния идеальных газов имеем
PV = |
mп |
R0T, |
PнпV = |
mпв |
R0T, |
(12.9) |
||
|
|
|||||||
|
μ |
пв |
|
|
μ |
пв |
|
|
|
|
|
|
|
|
|||
где μпв - молекулярный вес паров воды, а V=1 м3 . Из соотношения (12.8) и (12.9) следует, что
ϕ = |
mп |
100% = |
Pн |
100%, |
(12.10) |
|
|
||||
|
mнп |
Рнп |
|
||
т.е. возможно иное определение φ.
ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ ВОЗДУХА ВЫРАЖАЕТСЯ В ПРОЦЕНТАХ КАК ОТНОШЕНИЕ ДЕЙСТВИТЕЛЬНОЙ УПРУГОСТИ ВОДЯНОГО ПАРА К МАКСИМАЛЬНОЙ ЕГО УПРУГОСТИ, СООТВЕТСТВУЮЩЕЙ ДАННОЙ ТЕМПЕРАТУРЕ.
Если в объеме есть газ, то можно считать, что давление паров воды в объеме не зависит от давления газа. Покажем, как прямым способом могут быть измерены mn и mnв . Для этой цели можно приспособить химический
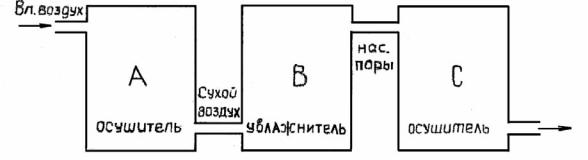
гигрометр (рис.12.2): влажный газ пропускают через закрытые осушительные трубки А, заполненные рыхлой массой эффективного поглотителя влаги; после этого сухой газ пропускают через U-образные трубки В с пористой стеклянной ватой, пропитанной до полного насыщения водой. При прохождении через трубки В воздух насыщается парами воды; затем его пропускают через серию осушительных трубок С. Взвешиванием трубок А и С до и после пропускания газа определяют величины mn и mnв .
Рис.12.2. Схема химического гигрометра
114

Влагосодержание. Влагосодержание влажного воздуха равно отношению массы пара mn во влажном воздухе к массе сухого воздуха mc ,
содержащегося во влажном воздухе: |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
d = тп = |
|
μпРп |
. |
|
|
|
|
|
|
|
(12.11) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
т |
|
μ Р |
|
|
|
|
|
|
|
|
|||
Из (12.9) следует, что |
|
|
|
с |
|
с с |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
d = тп = |
μпРп |
= |
18 |
Рп |
= 0.622 |
Рп |
|
, |
|
|
|
|
(12.12) |
|||||
|
|
|
|
Р − Р |
|
|
|
|
|||||||||||
|
т |
μ Р |
29 Р |
|
|
|
|
|
|
|
|
|
|||||||
где μп =18, |
с |
|
с |
с |
|
|
с |
|
|
|
|
п |
|
|
|
|
|
|
|
μс = 29, |
Р = Рп + Рс. |
|
|
|
|
|
|
|
|
|
|
|
|||||||
Влагосодержание воздуха в состоянии насыщения достигает |
|||||||||||||||||||
максимального значения dнп и равно |
|
|
|
|
|
|
|
|
|||||||||||
|
dнп = 0.622 |
|
Рнп |
|
|
|
или |
Рнп |
= Р |
dнп |
|
|
, |
(12.13) |
|||||
|
Р − Р |
|
0.622 + d |
нп |
|||||||||||||||
|
|
|
|
|
|
нп |
|
|
|
|
|
|
|
|
|
||||
где Pнп - |
давление |
насыщенных |
паров, |
связанное |
с температурой |
||||||||||||||
(см.табл.12.2). Избыток воды над влагосодержанием |
dнп |
при насыщении |
|||||||||||||||||
может содержаться в воздухе только в виде жидкости (капли, туман) или
твердой фазы (снег). Содержание воды (влаги) dвл |
в 1 кг воздуха равно |
dвл = d − dнп. |
(12.14) |
Точка росы. Если воздух данной влажности повысит свою температуру, то его относительная влажность понизится, как это следует из табл.12.2. Наоборот, при охлаждении воздуха по мере понижения температуры будет увеличиваться его относительная влажность.
Рис.12.3. Диаграмма состояний воды
115

При некоторой температуре, когда Р = Pнп , воздух получит относительную
влажность φ=100%, т.е. достигнет полного насыщения водяным паром. Эта температура носит название температуры точки росы для данной влажности воздуха.
Если продолжать понижать температуру, то излишнее количество влаги начнет конденсироваться. Температура tP при заданном парциальном давлении водяного пара равна температуре насыщения и определяется по таблицам насыщенного водяного пара. Конденсация излишней влаги при понижении температуры наблюдается в природе в виде образования туманов.
Изменение агрегатного состояния. Переход от одного агрегатного состояния в другое удобно рассматривать на диаграмме P-t (рис.12.3). Кривая АС является зависимостью между давлением насыщенного пара Pнп и температурой кипения и заканчивается в критической точке С.
Кривая АД представляет собой кривую зависимости давления от температуры плавления P = f (tпл) а АВ – от температуры сублимации.
Кривые P = f (t) описывают двухфазные состояния и только в точке А (тройная точка) одновременно существуют три фазы. Для воды это t0 = 0.0098oC, Pнп = 4.58мм рт. ст. . Расположение и вид кривых в диаграмме зависят от природы вещества и устанавливаются опытным путем.
12.3. Конденсация влаги на поверхностях
Рассмотрим условия конденсации влаги на поверхностях различных устройств. Для этого предварительно разберем несколько примеров, связанных с определением параметров, при которых возникает конденсация влаги.
Пример 1. Определить точку росы для воздуха, имеющего температуру +20°С при относительной влажности φ = 70%.
Решение. По табл.12.2 находим, что при t=20ºC, Pнп =17.54 мм
ртутного столба. Из формулы |
(12.10) следует, что действительная |
упругость паров будет составлять |
только 70% от Pнп , т.е. Pп = φPнп , |
Pп =17.54·0.7=12.28 мм рт. ст.
Та температура, для которой 12.28 мм будет соответствовать максимальной упругости паров, и будет точкой росы, т.е.
tp ≤15oC , а точнее tp =14.4oC .
Пример 2. При температуре +18°С воздух имеет относительную влажность φ = 60%. Как изменится φ: а) при повышении температуры до +22°С; б) при понижении температуры до 15°С?
Решение. мм, отсюда упругость пара при φ = 60%.
Pп(t =18oC, ϕ = 60%) =ϕ Pнп =15.48 0.60 = 9.29 мм.
116

а) |
Pнп(t = 22oC) =19.83 мм, а Pп =9.29мм осталось без изменения, |
|||||
следовательно, по (12.10) находим ϕ = |
9.29 |
|
100 = 47% ; |
|||
|
||||||
|
19.83 |
|
|
|||
б) |
Pнп(t =15oC) =12.79 мм, ϕ = |
9.29 |
100 = 73% . |
|
||
12.79 |
|
|||||
Точка росы во всех случаях будет одна и та же, соответствующая
Pп =9.29 мм, т.е. из табл.12.2 tp =10.1oC .
Явление конденсации влаги обнаруживается прежде всего в тех местах сооружений, приборов, в которых температура является наименьшей: в наружных углах стен, на корпусах приборов. Сформулируем условия конденсации влаги: 1) tB < tp - конденсация по всей
поверхности сооружения; 2) tB > tp > tmin - конденсация на тех частях
сооружения, где температура минимальна. При расчете различных аппаратов, приборов, сооружений необходимо обеспечить на их внутренних поверхностях такую температуру t, чтобы t > tp для данной
влажности воздуха. При этом следует брать максимально допустимые значения влажности. Источниками влаги являются люди, осветительные и нагревательные приборы и просто предметы, содержащие влагу. Количество влаги, выделяемое в некоторых случаях, приведено в табл.12.3.
Таблица 12.3
Из последнего примера следует важный вывод о влажностном режиме сооружений, приборов, устройств и т.д.: относительная влажность в общем случае различна в разных местах устройства, т.к. упругость водяного пара одинакова по всему объему, а температура различна.
Пример 3. На рис.12.4 схематически представлены некоторые
аппараты, |
температуры |
поверхностей |
которых |
равны |
t1 = 7.6oC, t2 |
= 9.oC, t3 =13.4oC ; |
аппараты находятся |
в помещении с |
|
температурой воздуха tB =18oC . |
|
|
||
117

Рис.12.4. К расчёту влажностного режима приборов
Найти предельные значения влажности воздуха, при которых может происходить конденсация на поверхностях аппаратов.
По формуле (12.10) определяем предельные значения относительной влажности, при которой еще существует конденсация:
ϕ1 = 157..8348100 = 50.5% ; ϕ2 = 158..7948100 = 57% ; ϕ3 = 1511..4853100 = 74.5%.
12.4. Энтальпия влажного газа
Энтальпия влажного газа i равна сумме энтальпий отдельных частей, составляющих парогазовую смесь. Влагосодержание d не превышает предела насыщения d ≤ dнп . В этом случае смесь содержит только сухой
газ и пары; при этом энтальпии газа и пара равны:
ic = Cpct, in = Cpnt +ir , Дж/ кг, |
(12.15) |
где Cpc и Cpп - изобарные удельные теплоемкости сухого газа и пара; ir -
удельная теплота испарения (энтальпия испарения).
Энтальпия влажного газа равна сумме энтальпий 1 кг сухого воздуха (газа) и d кг водяного пара:
i = Cpct + (Cpct +ir )d. |
(12.16) |
В частности, для водяного пара |
|
Cpc =1005 Дж/ кг К, Срп =1968 Дж/ кг К, ir = 2491 103 |
Дж/ кг, |
и уравнение (12.16) можно представить в виде |
|
i =1005t + (2491 103 +1968t)d . |
(12.17) |
118

Воздух перенасыщен водяным паром d ≥ dнп . Для перенасыщенного воздуха его влагосодержание d > dнп при той же температуре, т.е. часть влаги ( d − dнп ) находится в состоянии тумана. В этом случае необходимо учесть энтальпию воды в жидкой фазе.
i = Cpct + (Cpnt +ir )dнп + (d − dнп )Сpct |
(12.18) |
Энтальпия воздуха с туманом из кристалликов льда |
(12.19) |
i = Cpct + (Cpnt +ir )dнп + (d − dнп )Слt − (d − dнп )iпл, |
|
где iпл = 80 ккал/ кг - теплота плавления льда; Сл = 0.5 ккал/ кг град |
удельная |
теплоемкость льда. |
|
Энтальпия льда – отрицательная величина, т.к. энтальпия воды в жидкой фазе при 0°С считается равной нулю.
Смешение воздуха. Пусть смешивается G1 кг воздуха при температуре t1 и влагосодержании d1 с G2 кг воздуха, имеющим параметры t2 и d2 . При смешении отсутствует теплообмен с внешней средой; параметры смеси будем обозначать с индексами m.
Массовый баланс смеси G1d1 +G2d2 = (G1 +G2 )dm . Энергетический баланс смеси G1i1 +G2i2 = (G1 +G2 )im .
Из этих зависимостей следует, что
dm = |
d1 + d2a |
, |
im = |
i1 + ai2 |
, |
a = G2 . |
|
(12.20) |
||||
|
1+ a |
|
||||||||||
|
1+ a |
|
|
|
G |
|
|
|
||||
|
|
|
|
|
|
1 |
|
|
|
|||
Пример. В сложной установке смонтирован воздухоохладитель, |
||||||||||||
производительность которого GV |
=105 |
м3 |
|
при давлении 105 |
н/ м2 |
(750 мм |
||||||
c |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||
рт.ст.), температуре t=4ºC и относительной влажности φ=80%. По технологическим условиям воздух должен охлаждаться до 0ºC. Определить количество тепла, которое необходимо отнять для охлаждения воздуха, и количество влаги, выпадающей на поверхности охладителя.
Решение.
1) Давление насыщенного пара при t=4ºC находим из табл.12.2:
мм рт. ст. По формуле (12.10) определяем Pп - парциальное давление
(упругость) Pп =ϕ Pнп = 0.8 6.10 = 4.90 мм рт.ст.
2) Влагосодержание влажного воздуха на входе в охладитель находим по
формуле (12.12): d = 0.622 |
Pn |
= 0.622 |
4.90 |
= 0.0048 кг/ кг. |
|
P − P |
745 − 4.90 |
||||
|
|
|
|||
|
n |
|
|
|
3) Энтальпию влажного воздуха на входе в охладитель находим по формуле (12.17): i =1005 4 + (2491 103 +1968 4) 4.1 10−3 =14.23 кДж/ кг.
Найдем влагосодержание насыщенного воздуха dнп на выходе из
охладителя при температуре t=0ºC и давлении насыщенного пара Pнп(t = 0oC) = 4.6 мм рт.ст. По формуле (12.13) находим
119
dнп = 0.622 |
|
4.58 |
≈ 3.83 10−3 кг/ кг. |
|
745 − 4.58 |
||||
|
|
|||
4) Количество выпавшей влаги |
d на каждый кг воздуха |
|||
d= d − dнп = (4.08 − 3.83) 10−3 = 0.25 10−3 кг/ кг
5)Количество сухого воздуха, приходящего через воздухоохладитель. Поделим обе части (12.9) на τ :
|
(Р − Р )G = G R0T , G = |
v |
,G mn , G = G |
(P − Pn )μ = 3.47 кг/ с. |
||||
|
|
|||||||
|
п V |
μ |
|
V |
τ |
τ |
V |
R T |
|
|
|
|
|
|
|
|
0 |
6) |
Энтальпия влажного воздуха на выходе из охладителя при t=0ºC. По |
|||||||
формуле(12.18)находим |
|
|
|
|
|
|
||
i′ = Cpc 0 + (Cpn 0 + 2491 103 )dнп + (d − dнп )Сж 0 = 9.57 кДж/ кг. |
||||||||
7) |
Изменение энтальпии 1 кг влажного воздуха при его охлаждении в |
|||||||
охладителе i = i′−i = 9.57 −14.23 = −4.63 кДж/ кг. |
||||||||
8) |
Количество тепла, отводимое от всего воздуха, проходящего через |
|||||||
охладитель в 1с Q = G i = 34.7(−4.63) = −161 |
кДж/ кг. |
|||||||
9) Количество влаги, выпавшей на поверхности охладителя |
||||||||
|
G |
= G(d − d |
нп |
) = 34.7 0.25 10−3 = 8.67 10−3 кг/ с. |
||||
|
вл |
|
|
|
|
|
|
|
12.5. Тройная аналогия
Рассмотрим уравнения диффузии, энергии и движения, описывающие поля концентраций, температуры и скорости в раздельно идущих процессах переноса вещества, тепла и количества движения. Жидкость будем считать несжимаемой.
Уравнение массообмена (без учета термо- и бародиффузии)
dρ |
= D 2 ρ. |
(12.21) |
|
dτ |
|||
|
|
Уравнение энергии (без учета диффузии)
dt |
= a 2t. |
(12.22) |
|
dτ |
|||
|
|
Уравнение движения (без учета массовых сил и для безнапорного движения ∂∂Px = 0 )
dv |
=ν 2v. |
(12.23) |
|
dτ |
|||
|
|
Уравнения (12.21) - (12.23) по записи аналогичны. Эти уравнения содержат три физических параметра: D, a, ν, каждый из которых характеризует соответственно перенос вещества, тепла и импульса.
Единицы измерения D, a и ν одинаковы - |
м2 |
. При D=a=ν расчетные поля |
|
с |
|||
|
|
концентраций, температур и скорости будут подобны, если только имеет
120
