
- •Тема 1. Лабораторное оборудование
- •Экспериментальная часть Лабораторная работа. Химическая посуда и оборудование
- •Методика работы
- •Тема 2. Обработка результатов экспериментов Основные определения и термины
- •2.1. Построение и содержание отчета
- •2.2. Правила построения таблиц
- •2.3. Графическое изображение экспериментальных данных
- •Тема 3. Численное выражение состава раствора Основные определения и термины
- •Вопросы для самостоятельной подготовки и контроля
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 4. Индикаторы и титрование Основные определения и термины
- •Экспериментальная часть Лабораторная работа 4.1. Определение активной кислотности растворов по изменению окраски индикаторов
- •Методика работы
- •Лабораторная работа 4.2. Определение концентрации раствора щелочи титрованием
- •Методика работы
- •Лабораторная работа 4.3. Определение концентрации раствора кислоты титрованием
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 5. Химическая кинетика и равновесие Основные определения и термины
- •Экспериментальная часть Лабораторная работа 5.1. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •Методика работы
- •Результаты опытов
- •Лабораторная работа 5.2. Зависимость скорости реакции от температуры
- •Методика работы
- •Лабораторная работа 5.3. Влияние концентрации реагирующих веществ на химическое равновесие
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 6. Буферные растворы Основные определения и термины
- •Экспериментальная часть Лабораторная работа 6.1. Приготовление буферных смесей
- •Методика работы
- •Лабораторная работа 6.2. Влияние разбавления на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.3. Влияние кислоты и щелочи на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.4. Определение буферной емкости раствора
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 7. Потенциометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 7.1. Определение рН с использованием двойной хингидронной цепи
- •Методика работы
- •Лабораторная работа 7.2. Измерение электродного потенциала окислительно-восстановительного электрода
- •Методика работы
- •Лабораторная работа 7.3. Потенциометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 8. Кондуктометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 8.1. Кондуктометрическое определение электрической проводимости растворов слабых электролитов
- •Методика работы
- •Лабораторная работа 8.2. Кондуктометрическое определение проводимости растворов сильных электролитов
- •Методика работы
- •Лабораторная работа 8.3. Кондуктометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 9. Физико-химия поверхностных явлений. Хроматография Основные определения и термины
- •Экспериментальная часть Лабораторная работа 9.1. Определение поверхностного натяжения
- •Методика работы
- •Лабораторная работа 9.2. Измерение поверхностного натяжения растворов пав сталагмометрическим методом
- •Методика работы
- •Лабораторная работа 9.3. Влияние растворителя на адсорбцию
- •Методика работы
- •Лабораторная работа 9.4. Адсорбция электролитов, красителей и золей углем
- •Методика работы
- •Лабораторная работа 9.5. Хроматографическое разделение ионов железа, меди и кобальта
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 10. Получение и очистка коллоидных систем Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение золей
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 11. Получение и использование эмульсий Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение и обращение фаз эмульсий
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Список рекомендуемой литературы
- •Приложения
- •1. Плотность растворов сильных кислот и щелочей
- •2. Интервалы перехода окраски некоторых индикаторов
- •3. Удельная электрическая проводимость , См/м,
- •4. Предельная эквивалентная электрическая проводимость
- •5. Константы диссоциации слабых кислот и оснований
- •6. Стандартные электродные потенциалы
- •7. Буферные ряды
- •8. Поверхностное натяжение и плотность воды
- •9. Физико-химические свойства
- •Оглавление
- •428015 Чебоксары, Московский просп., 15
Тема 3. Численное выражение состава раствора Основные определения и термины
Имея дело с растворами, удобно называть один из компонентов растворителем, а другие компоненты – растворенными веществами. Рассмотрим пример: при смешении хлорида натрия (твердое вещество) с водой получается жидкий раствор. Поэтому вода – растворитель, хлорид натрия – растворенное вещество.
Таким образом, растворителем называют компонент раствора, сохраняющий свое физическое состояние при образовании раствора. Если все компоненты раствора до перемешивания находятся в одинаковой фазе, растворителем называют тот компонент, который содержится в наибольшем количестве; остальные вещества называют растворенными веществами. Растворимость твердых веществ с повышением температуры большей частью увеличивается.
Под концентрацией понимают количество вещества, растворенного в заданном объеме раствора или растворителя. Концентрацию раствора можно охарактеризовать качественно и количественно. Для качественного описания концентрации используются такие понятия, как разбавленный, концентрированный, ненасыщенный, насыщенный и пересыщенный раствор.
Мерой растворимости вещества служит его концентрация его насыщенного раствора при данной температуре. Количественно растворимость принято выражать числом граммов вещества, которое при данной температуре можно растворить в 100 г растворителя. Это число называется коэффициентом растворимости или растворимостью вещества. Например, растворимость NaCl в воде при 20 оС составляет 36,0 г. Если при этой температуре в указанный раствор добавить еще некоторое количество NaCl, то добавленный избыток не растворится, а останется в виде осадка. Такой раствор называется насыщенным.
Раствор, содержащий растворимое вещество в меньшем количестве, чем его содержится в насыщенном растворе (меньше, чем его растворимость), называется ненасыщенным. Пересыщенный раствор – раствор, в котором растворено количество вещества больше, чем его растворимость.
О растворе с низкой концентрацией растворенного вещества принято говорить, как о разбавленном. Концентрированный раствор – раствор с высоким содержанием растворенного вещества.
Растворы характеризуются молярной концентрацией, молярной, массовой, объемной долей растворимого вещества.
В химических расчетах чаще всего применяется молярная концентрация. Молярную концентрацию раствора определяют как количество вещества, моль, растворенного в литре раствора:
![]() .
.![]() (3.1)
(3.1)
Единица молярной концентрации – моль/л.
Молярная доля компонента раствора определяется уравнением
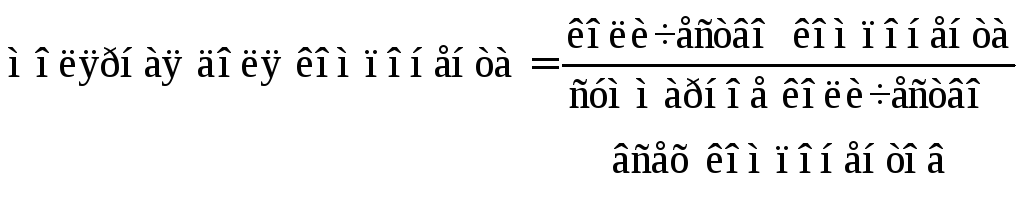 .
(3.2)
.
(3.2)
Массовая доля – отношение массы растворенного вещества к объему раствора. Математическое определение массовой доли компонента раствора дается уравнением
![]() .
(3.3)
.
(3.3)
Объемная доля – количество объемов растворенного вещества в 100 объемах раствора. Например, указано, что растворимость водорода равна 0,0125; это означает, что в 100 л раствора содержится 0,0125 л водорода, или 12,5 мл.
Единицы молярной, массовой, объемной доли – %, ‰, млн–1.
Для обозначения молярной доли раствора обычно используется символ Х с индексом, указывающим компонент, о котором идет речь. Например, молярная доля НСl в растворе соляной кислоты записывается как ХНС1. Сумма молярных долей всех компонентов раствора должна быть равна единице.
Моляльность определяется как количество растворенного вещества в килограмме растворителя.
![]() .
(3.4)
.
(3.4)
Единица моляльности – моль/кг.
Иногда концентрацию раствора выражают через его плотность. Определенной плотности раствора чистого вещества при данной температуре соответствует определенное (известное) содержание вещества в нем. Например, раствор серной кислоты пл. 1,170 г/см3 при 20 оС содержит 24 % H2SO4. для определения концентрации раствора по его плотности пользуются справочными таблицами (прил. 1).
Зная плотность раствора, по справочнику находят долю растворенного вещества в нем. Вычисляют концентрацию раствора.
Для перехода от массы к объему можно воспользоваться формулой
V = m / d , (3.6)
где V, m , d – соответственно объем, масса и плотность.
