- •Тема 1. Лабораторное оборудование
- •Экспериментальная часть Лабораторная работа. Химическая посуда и оборудование
- •Методика работы
- •Тема 2. Обработка результатов экспериментов Основные определения и термины
- •2.1. Построение и содержание отчета
- •2.2. Правила построения таблиц
- •2.3. Графическое изображение экспериментальных данных
- •Тема 3. Численное выражение состава раствора Основные определения и термины
- •Вопросы для самостоятельной подготовки и контроля
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 4. Индикаторы и титрование Основные определения и термины
- •Экспериментальная часть Лабораторная работа 4.1. Определение активной кислотности растворов по изменению окраски индикаторов
- •Методика работы
- •Лабораторная работа 4.2. Определение концентрации раствора щелочи титрованием
- •Методика работы
- •Лабораторная работа 4.3. Определение концентрации раствора кислоты титрованием
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 5. Химическая кинетика и равновесие Основные определения и термины
- •Экспериментальная часть Лабораторная работа 5.1. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •Методика работы
- •Результаты опытов
- •Лабораторная работа 5.2. Зависимость скорости реакции от температуры
- •Методика работы
- •Лабораторная работа 5.3. Влияние концентрации реагирующих веществ на химическое равновесие
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 6. Буферные растворы Основные определения и термины
- •Экспериментальная часть Лабораторная работа 6.1. Приготовление буферных смесей
- •Методика работы
- •Лабораторная работа 6.2. Влияние разбавления на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.3. Влияние кислоты и щелочи на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.4. Определение буферной емкости раствора
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 7. Потенциометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 7.1. Определение рН с использованием двойной хингидронной цепи
- •Методика работы
- •Лабораторная работа 7.2. Измерение электродного потенциала окислительно-восстановительного электрода
- •Методика работы
- •Лабораторная работа 7.3. Потенциометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 8. Кондуктометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 8.1. Кондуктометрическое определение электрической проводимости растворов слабых электролитов
- •Методика работы
- •Лабораторная работа 8.2. Кондуктометрическое определение проводимости растворов сильных электролитов
- •Методика работы
- •Лабораторная работа 8.3. Кондуктометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 9. Физико-химия поверхностных явлений. Хроматография Основные определения и термины
- •Экспериментальная часть Лабораторная работа 9.1. Определение поверхностного натяжения
- •Методика работы
- •Лабораторная работа 9.2. Измерение поверхностного натяжения растворов пав сталагмометрическим методом
- •Методика работы
- •Лабораторная работа 9.3. Влияние растворителя на адсорбцию
- •Методика работы
- •Лабораторная работа 9.4. Адсорбция электролитов, красителей и золей углем
- •Методика работы
- •Лабораторная работа 9.5. Хроматографическое разделение ионов железа, меди и кобальта
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 10. Получение и очистка коллоидных систем Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение золей
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 11. Получение и использование эмульсий Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение и обращение фаз эмульсий
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Список рекомендуемой литературы
- •Приложения
- •1. Плотность растворов сильных кислот и щелочей
- •2. Интервалы перехода окраски некоторых индикаторов
- •3. Удельная электрическая проводимость , См/м,
- •4. Предельная эквивалентная электрическая проводимость
- •5. Константы диссоциации слабых кислот и оснований
- •6. Стандартные электродные потенциалы
- •7. Буферные ряды
- •8. Поверхностное натяжение и плотность воды
- •9. Физико-химические свойства
- •Оглавление
- •428015 Чебоксары, Московский просп., 15
Методика работы
Сущность метода потенциометрического титрования состоит в том, что точка эквивалентности (т.э.) находится по резкому изменению потенциала индикаторного электрода, чувствительного к титруемым ионам. В начале титрования потенциал индикаторного электрода изменяется медленно, но вблизи точки эквивалентности потенциал индикаторного электрода изменяется скачком при добавлении нескольких капель титрующего раствора.
При потенциометрическом титровании кислот нет необходимости вычислять потенциал индикаторного электрода. Интегральные и дифференциальные кривые титрования можно начертить по результатам измерения ЭДС гальванического элемента или рН раствора. Для определения их значений удобно воспользоваться рН-метром. В качестве индикаторного электрода в приборе pH-340 (см. рисунок в теме 6) служит стеклянный электрод, а в качестве электрода сравнения – хлорсеребряный.
Порядок измерения pH на приборе pH-340 описан в теме 6 «Буферные растворы».
При использовании прибора рН-метра как милливольтметра следует иметь в виду, что в приборе предусмотрена возможность измерения электродвижущихся сил различной полярности. При отсчете показаний на участке шкалы от 0 до 1400 мВ знак, соответствующий положению ручки переключателя «Род работы» в момент измерения, соответствует знаку потенциала индикаторного (измерительного) электрода. Показания, отсчитанные на любом диапазоне измерения, необходимо умножить на 100.
Примеры:
1. Переключатель диапазонов установлен в положение «11–14», а стрелка показывающего прибора установилась на значении 0,25. Измеренное значение ЭДС: (11+0,25)100 = = 11,25·100 = 1125 мВ.
2. Переключатель диапазонов установлен в положении «–1–4», стрелка показывающего прибора установилась на значении 0,25. Измеренное значение ЭДС: (–1+0,25)100 = = –0,75·100 = –75 мВ.
В химический стакан для титрования наливают 10 мл исследуемого раствора кислоты (НСl концентрации 0,1 моль/л), а бюретка с делением не более 0,1 мл заполняется титрованным раствором NаОН концентрации 0,1 моль/л.
Электроды рН-метра погружают в исследуемый раствор и измеряют ЭДС гальванического элемента или рН. Измерение ЭДС гальванического элемента начинают, приливая в раствор кислоты по 1 мл щелочи из бюретки. Перемешивают раствор и через 2–3 мин вновь измеряют ЭДС. Продолжают приливать по 1 мл щелочи и измерять ЭДС, пока общий объем прилитой щелочи не достигнет 7 мл. При приближении к точке эквивалентности, когда суммарный объем прибавленной щелочи достигнет 8 мл, следует прибавлять по 0,2 мл раствора щелочи. Максимальное изменение ЭДС указывает на то, что точка эквивалентности достигнута. После точки эквивалентности опыт не прекращают, а продолжают титрование, добавляя по 0,5 мл щелочи 2–3 раза. При добавлении порции титранта после точки эквивалентности наблюдается скачок потенциала.
Результаты титрования заносят в табл. 7.3.
Таблица 7.3
Результаты эксперимента
|
Номер опыта |
Объем добавленной щелочи Vщ, мл |
V, мл |
Е, мВ, или рН |
Е, мВ, или рН |
Е/V, мВ/мл , или рН/V, мл – 1 |
|
|
|
|
|
|
|
|
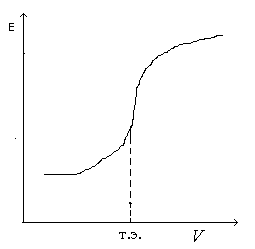
Рис. 7.3. Интегральная кривая потенциометрического титрования
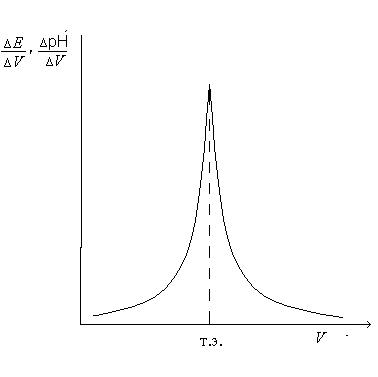
Рис. 7.4. Дифференциальная кривая потенциометрического титрования |
По полученным данным строят интегральную кривую титрования (рис. 7.3). ЭДС гальванического элемента Е (ось ординат) – объем прибавленного титранта V (ось абсцисс). По перегибу кривой определяют точку эквивалентности (т.э.), которая соответствует объему титранта, израсходованного на титрование. Чтобы определить точку эквивалентности более точно, строят дифференциальную кривую титрования (рис. 7.4). Для построения кривой на оси ординат откладывают отношение изменения ЭДС Е соответствующему изменению объема прибавляемой щелочи V, а на оси абсцисс – объём добавленной щелочи Vщ. Точку эквивалентности можно также найти, измеряя рН после каждой прибавленной порции щелочи и построив график |
зависимости в координатах рН/V – Vщ.
Определив объем раствора щелочи, израсходованного для полной нейтрализации данного объема раствора кислоты, рассчитывают ее концентрацию по формуле
Скисл = Сщ Vщ. т. э / Vкисл,
где Сщ – концентрация щелочи; Vщ. т. э – объем добавленной щелочи в точке эквивалентности; Vкисл – объем кислоты (10 мл).