- •Тема 1. Лабораторное оборудование
- •Экспериментальная часть Лабораторная работа. Химическая посуда и оборудование
- •Методика работы
- •Тема 2. Обработка результатов экспериментов Основные определения и термины
- •2.1. Построение и содержание отчета
- •2.2. Правила построения таблиц
- •2.3. Графическое изображение экспериментальных данных
- •Тема 3. Численное выражение состава раствора Основные определения и термины
- •Вопросы для самостоятельной подготовки и контроля
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 4. Индикаторы и титрование Основные определения и термины
- •Экспериментальная часть Лабораторная работа 4.1. Определение активной кислотности растворов по изменению окраски индикаторов
- •Методика работы
- •Лабораторная работа 4.2. Определение концентрации раствора щелочи титрованием
- •Методика работы
- •Лабораторная работа 4.3. Определение концентрации раствора кислоты титрованием
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 5. Химическая кинетика и равновесие Основные определения и термины
- •Экспериментальная часть Лабораторная работа 5.1. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •Методика работы
- •Результаты опытов
- •Лабораторная работа 5.2. Зависимость скорости реакции от температуры
- •Методика работы
- •Лабораторная работа 5.3. Влияние концентрации реагирующих веществ на химическое равновесие
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 6. Буферные растворы Основные определения и термины
- •Экспериментальная часть Лабораторная работа 6.1. Приготовление буферных смесей
- •Методика работы
- •Лабораторная работа 6.2. Влияние разбавления на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.3. Влияние кислоты и щелочи на рН буферного раствора
- •Методика работы
- •Лабораторная работа 6.4. Определение буферной емкости раствора
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 7. Потенциометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 7.1. Определение рН с использованием двойной хингидронной цепи
- •Методика работы
- •Лабораторная работа 7.2. Измерение электродного потенциала окислительно-восстановительного электрода
- •Методика работы
- •Лабораторная работа 7.3. Потенциометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 8. Кондуктометрия Основные определения и термины
- •Экспериментальная часть Лабораторная работа 8.1. Кондуктометрическое определение электрической проводимости растворов слабых электролитов
- •Методика работы
- •Лабораторная работа 8.2. Кондуктометрическое определение проводимости растворов сильных электролитов
- •Методика работы
- •Лабораторная работа 8.3. Кондуктометрическое титрование
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 9. Физико-химия поверхностных явлений. Хроматография Основные определения и термины
- •Экспериментальная часть Лабораторная работа 9.1. Определение поверхностного натяжения
- •Методика работы
- •Лабораторная работа 9.2. Измерение поверхностного натяжения растворов пав сталагмометрическим методом
- •Методика работы
- •Лабораторная работа 9.3. Влияние растворителя на адсорбцию
- •Методика работы
- •Лабораторная работа 9.4. Адсорбция электролитов, красителей и золей углем
- •Методика работы
- •Лабораторная работа 9.5. Хроматографическое разделение ионов железа, меди и кобальта
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 10. Получение и очистка коллоидных систем Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение золей
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Тема 11. Получение и использование эмульсий Основные определения и термины
- •Экспериментальная часть Лабораторная работа. Получение и обращение фаз эмульсий
- •Методика работы
- •Вопросы для самостоятельной подготовки и контроля
- •Список рекомендуемой литературы
- •Приложения
- •1. Плотность растворов сильных кислот и щелочей
- •2. Интервалы перехода окраски некоторых индикаторов
- •3. Удельная электрическая проводимость , См/м,
- •4. Предельная эквивалентная электрическая проводимость
- •5. Константы диссоциации слабых кислот и оснований
- •6. Стандартные электродные потенциалы
- •7. Буферные ряды
- •8. Поверхностное натяжение и плотность воды
- •9. Физико-химические свойства
- •Оглавление
- •428015 Чебоксары, Московский просп., 15
Вопросы для самостоятельной подготовки и контроля
1. Что называется удельной, молярной и эквивалентной электрической проводимостью? Как они взаимосвязаны?
2. Что такое константа ячейки и как она определяется?
3. Поясните зависимости удельной и эквивалентной электрической проводимостей от концентрации и разведения.
4. Как вычислить степень и константу диссоциации слабого электролита исходя из электрической проводимости раствора?
5. Как графически находят значение предельной электрической проводимости сильного электролита?
6. В чем сущность кондуктометрического метода титрования?
7. Поясните ход кривых кондуктометрического титрования а) раствора сильной кислоты раствором сильного основания; б) раствора слабой кислоты раствором сильного основания; в) смеси растворов сильной и слабой кислот раствором сильного основания.
8. Недостатки и достоинства кондуктометрического метода.
Тема 9. Физико-химия поверхностных явлений. Хроматография Основные определения и термины
Коллоидные системы являются высокодисперсными системами и отличаются от других гетерогенных систем наличием сильно развитой поверхности раздела фаз.
К поверхностным явлениям относят те эффекты и особенности поведения веществ, которые наблюдаются на поверхности раздела фаз (поверхностное натяжение, адсорбция, смачивание, адгезия и др.). Причиной поверхностных явлений служит особое состояние молекул в слоях жидкостей и твердых тел, непосредственно прилегающих к поверхности раздела. Эти слои резко отличаются по своим физико-химическим свойствам от свойств фаз в глубине их объема. Основное различие состоит в том, что поверхностный слой молекул твердого тела или жидкости обладает избытком энергии Гиббса в отличие от молекул объемной фазы. Наличие поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой.
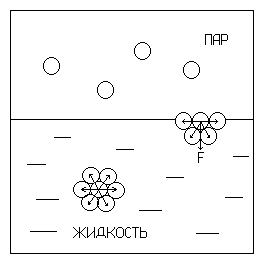
|
Рис. 9.1. Силы, действующие на молекулу в объеме жидкости и в поверхностном слое |
Рассмотрим действие молекулярных сил на молекулу в объеме жидкости и поверхностном слое на примере двухфазной системы жидкость – воздух (рис. 9.1). Силы сцепления, действующие со стороны окружающих молекул на молекулу А в объеме жидкости, одинаковы со всех сторон, следовательно, уравновешивают друг |
друга, и их равнодействующая F равна нулю. Силы, действующие на молекулу B поверхностного слоя границы раздела жидкости с ее паром, не одинаковы с силами со стороны раствора и газообразной фазы. Молекулярные взаимодействия с газообразной фазой практически отсутствуют. Для такой молекулы равнодействующая молекулярных сил F не равна нулю и направлена внутрь жидкой фазы и перпендикулярна поверхности раздела фаз. Равнодействующая всех молекул, образующих 1 м2 поверхности жидкости, называется молекулярным или внутренним давлением. Это давление стремится затянуть все молекулы с поверхности внутрь жидкой фазы. Под влиянием внутреннего давления поверхностный слой стремится сократиться. Для увеличения поверхности жидкости (для выхода молекул на поверхность) нужно преодолеть силу внутреннего давления и совершить определенную механическую работу Ws против сил молекулярного сцепления. В итоге формируется поверхностный слой с избыточной поверхностной энергией Гиббса Gs. Поверхностная энергия Гиббса системы пропорциональна межфазной поверхности S:
Gs = σS, (9.1)
где – коэффициент пропорциональности, называемый поверхностным натяжением, Н/м.
Поверхностное натяжение – величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оно численно равно работе, которую необходимо совершить в данной системе для образования в ней единицы поверхности раздела фаз при постоянной температуре.
Поверхностное натяжение в СИ выражается в ньютонах на метр (Н/м).
Поверхностное натяжение зависит от температуры, природы граничащих сред, природы и концентрации растворенных веществ. С повышением температуры поверхностное натяжение индивидуальных жидкостей на границе с воздухом линейно убывает.
Поверхностное натяжение изменяется от прибавления небольшого количества веществ, растворимых в данной жидкости. Способность растворенных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Одни вещества понижают поверхностное натяжение растворителя и называются поверхностно-активными веществами ПАВ, другие, практически не влияющие или повышающие – поверхностно-инактивными веществами (ПИВ). К ПАВ относятся органические кислоты, спирты, амины, простые и сложные эфиры, белки, мыла, красители, а к ПИВ – неорганические соли и некоторые органические вещества, например сахар, крахмал. Вещества, растворение которых не приводит к изменению поверхностного натяжения, называются поверхностно-неактивными (ПНВ). Это органические вещества, у которых много полярных групп, например сахарозы С12Н22О11, глюкозы С6Н12О6.
Самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз называется адсорбцией. Адсорбирующее вещество принято называть адсорбентом, а адсорбируемое – адсорбтивом или адсорбатом. Значение адсорбции выражают количеством адсорбтива на единицу площади поверхности адсорбента (Г, моль/м2). Значение адсорбции в растворах можно определить по изменению поверхностного натяжения с концентрацией растворенного вещества, используя уравнение Гиббса:
![]()
![]()
![]() ,
(9.3)
,
(9.3)
где С – равновесная концентрация вещества, моль/л или моль/м3; Т – абсолютная температура, К; d/dC – поверхностная активность (изменение поверхностного натяжения с концентрацией при неизменной площади поверхности), Джм/моль; R – универсальная газовая постоянная, Дж/(Кмоль); R = 8,31.
Поверхностное натяжение биологических жидкостей используют в диагностических целях. Так, поверхностное натяжение плазмы крови (= 45,4 Н/м при 298 К) варьируется в зависимости от заболевания (травма, шок, рана, рак и др.), с возрастом поверхностное натяжение сыворотки крови уменьшается. Поверхностное натяжение играет значительную роль в таких явлениях, как деление клеток и движение бактерий, влияет на проницаемость клеточных мембран и др.