
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
2.1. Примеры решения задач
Пример 6. Определить активность электролита AlCl3, если его молярная концентрация в водном растворе равна 0,02 моль/л.
Решение
Активность электролита
![]()
где
![]() –
средняя ионная активность электролита,
–
средняя ионная активность электролита,![]() .
.
Определим средний ионный стехиометрический
коэффициент
![]() и средний ионный коэффициент активности
и средний ионный коэффициент активности![]()
![]()
Ионная сила раствора Ic=6c=60,02=0,12, поэтому
![]()
Теперь определим активность электролита:
![]()
Пример 7. Определить средний коэффициент активности CuCl2в растворе, содержащем 0,02 моля CuCl2, 0,003 моля NiSO4и 0,005 моля H2SO4в 1 кг воды.
Решение
Для определения
![]() используем уравнение Дебая и Гюккеля
используем уравнение Дебая и Гюккеля
![]()
Определим ионную силу раствора электролитов
![]()
![]()
Пример 8. Определить коэффициент активности иона Fe2+в растворе, содержащем 0,03 моля FeCl2и 0,05 моля CuSO4в 1 кг воды.
Решение
Коэффициент активности иона Fe2+определим по уравнению Дебая и Гюккеля
![]()
Ионная сила раствора
![]()
![]()
Пример 9. Растворимость иодистого серебра AgI при 25 С равна 2,8610–6 г/л. Определить произведение растворимости AgI.
Решение
Для процесса диссоциации труднорастворимой соли
![]()
степень диссоциации
![]() ,
поэтому
,
поэтому
![]() ,
,
где
![]() – концентрация соли в насыщенном
растворе – растворимость, которая в
справочной литературе может обозначаться
– концентрация соли в насыщенном
растворе – растворимость, которая в
справочной литературе может обозначаться![]() .
.
Определим молярную концентрацию AgI в насыщенном растворе:
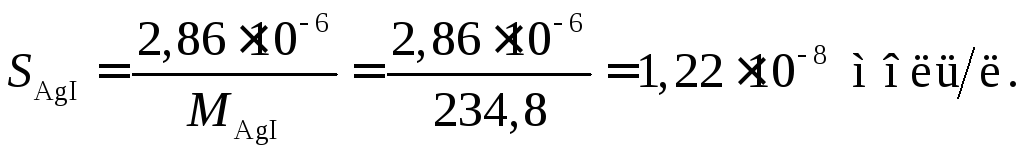
При такой малой растворимости коэффициент
активности принимаем равным единице,
поэтому произведение растворимости
определяем не произведением активностей
![]() ,
а произведением концентраций
,
а произведением концентраций![]() .
Получаем
.
Получаем
![]()
Пример 10.
Растворимость гидроксида Cd(OH)2равна 3,910–5 моль/л
при 25 С.
Вычислить ![]() с учетом активностей компонентов
раствора.
с учетом активностей компонентов
раствора.
Решение
Для диссоциации Cd(OH)2
![]() ;
;
![]()
Ионная сила раствора
![]()
Коэффициенты активности ионов определим по уравнению Дебая и Гюккеля:
![]()
![]()
![]()
Произведение растворимости, рассчитанное в предположении идеальности раствора (f=1), таково:
![]()
Как видно, даже для сильно разбавленных растворов, в которых коэффициенты активности мало отличаются от единицы, ошибка в определении произведения растворимости существенна и составляет
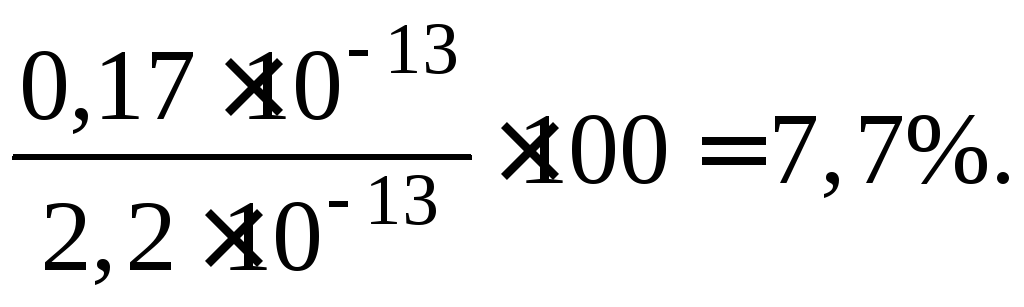
Пример 11.
Растворимость соли SrSO4в воде
равна 6,510–4 моль/л
при 25 С.
Вычислить ![]() и растворимость этой соли в 0,02 М растворе
CuSO4.
и растворимость этой соли в 0,02 М растворе
CuSO4.
Решение
В водном растворе соль SrSO4диссоциирует на ионы
![]()
Произведение растворимости
![]() Подсчитаем ионную силу раствора SrSO4и коэффициенты активности ионов,
принимая, что коэффициенты активности
двузарядных ионов одинаковы:
Подсчитаем ионную силу раствора SrSO4и коэффициенты активности ионов,
принимая, что коэффициенты активности
двузарядных ионов одинаковы:
![]()
Получим
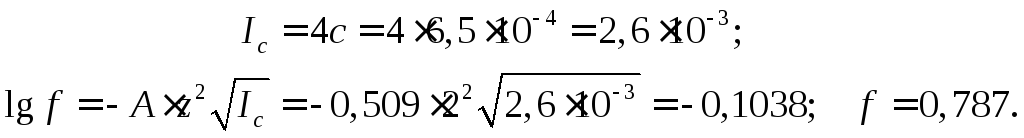
Отсюда
![]()
Теперь определим растворимость соли SrSO4в 0,02 М растворе CuSO4по уравнению
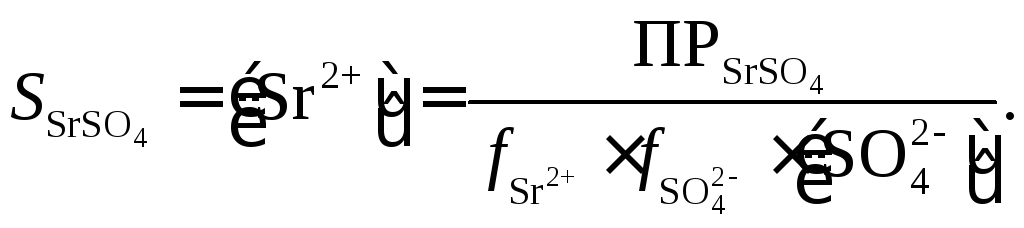
Вычислим ионную силу раствора, содержащего 6,510–4 моль/л SrSO4и 0,02моль/л CuSO4:
![]()
![]()
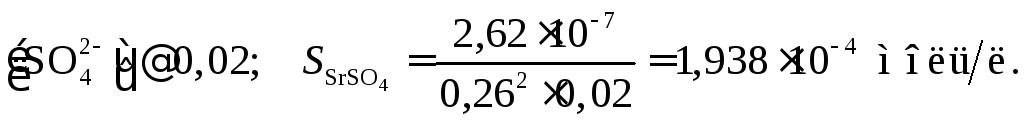
Таким образом, растворимость соли SrSO4в 0,02 М растворе CuSO4меньше, чем в
воде, в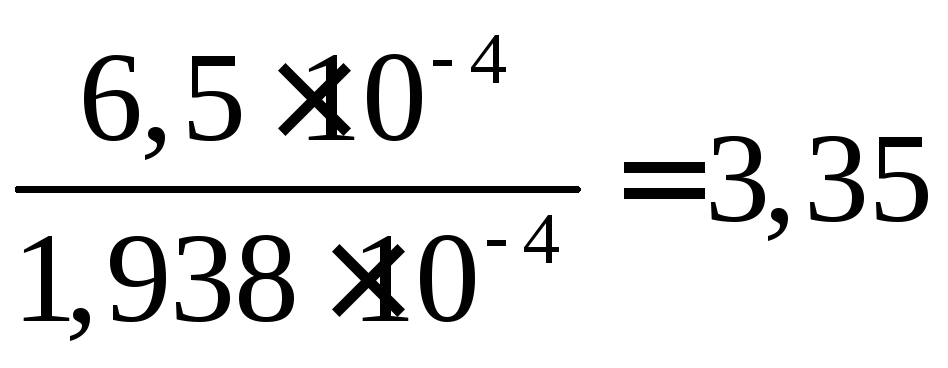 раза.
раза.
Пример 12. Определить, во сколько
раз уменьшится растворимость Zn(OH)2в 0,02 н растворе NaOH по сравнению с
растворимостью в чистой воде, если![]() .
.
Решение
Для труднорастворимого гидрата окиси цинка
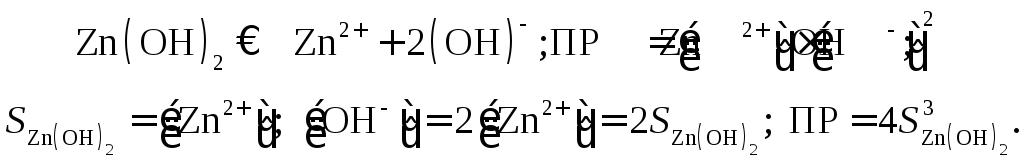
Растворимость Zn(OH)2в воде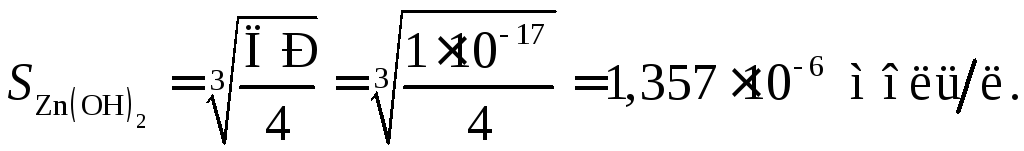
Ионная сила такого раствора
![]() поэтому сделанное выше допущение
поэтому сделанное выше допущение![]() не приводит к существенной ошибке в
вычислении растворимости Zn(OH)2в
воде.
не приводит к существенной ошибке в
вычислении растворимости Zn(OH)2в
воде.
Теперь определим растворимость Zn(OH)2в 0,02 н растворе NaOH. Ионная сила этого
раствора![]() Поэтому
Поэтому
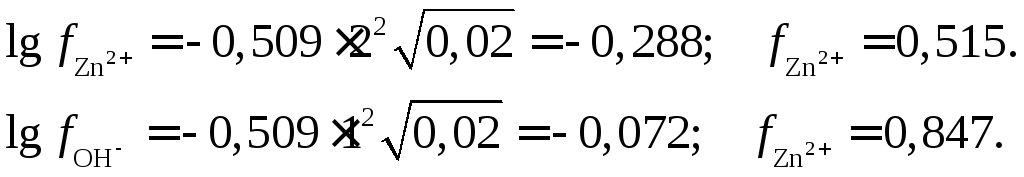
Таким образом, растворимость
![]() в 0,02 н растворе NaOH
в 0,02 н растворе NaOH
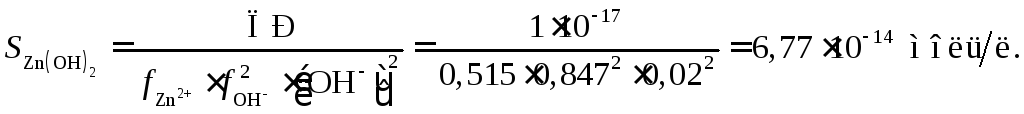
Растворимость в 0,02 н растворе NaOH
уменьшилась в
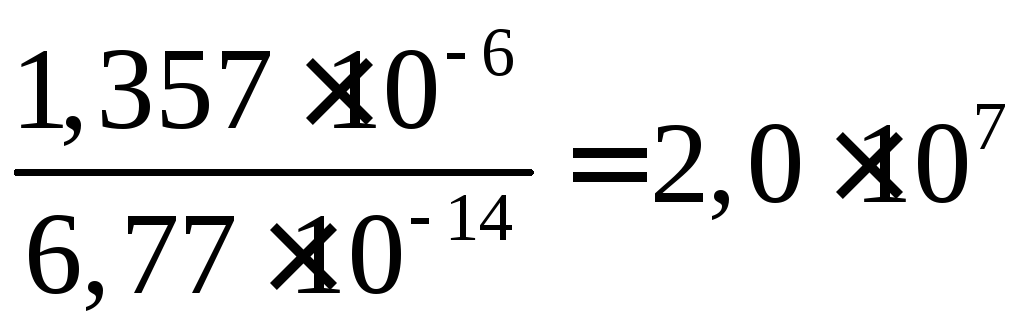 раза.
раза.
