
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
10.1. Примеры решения задач
Пример 51. Рассчитать удельный расход активных веществ при работе марганцово-цинкового гальванического элемента.
Решение
Расход активных веществ определяется количеством электричества, взятого от ХИТ. Поэтому на практике рассчитывают расход удельный – в граммах на 1 А·час. Закон Фарадея (см. уравнения (9.1) и (9.2))
![]()
для удельного расхода запишем
![]() ,
,
где число Фарадея F=
26,8 А·ч;![]() – эквивалентная масса.
– эквивалентная масса.
Суммарный процесс, протекающий в марганцово-цинкового гальванического элемента представлен уравнением (10.18)
![]() ,
,
которое, как следует
из уравнений (10.8) и (10.10), записано на 4
Фарадея электричества (4 электрона).
Поэтому![]()
![]() и
и![]() ,
а удельные расходы активных веществ
,
а удельные расходы активных веществ
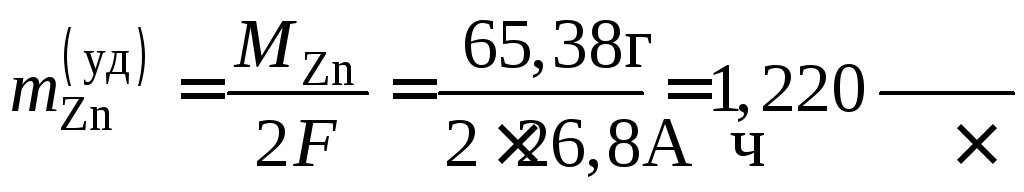 ;
;
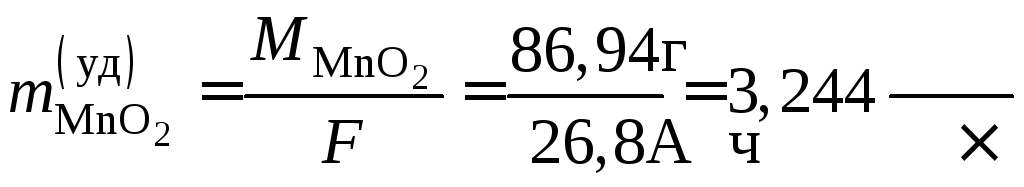 ;
;
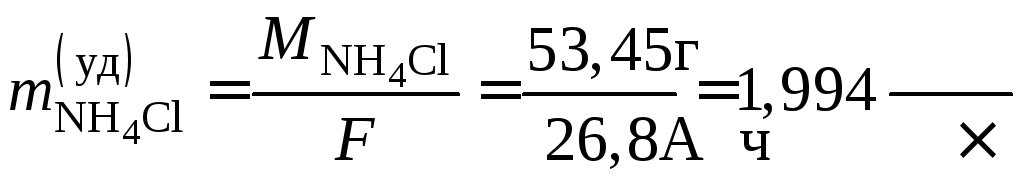 .
.
Пример 52.
Рассчитать стандартный потенциал
электрода![]() при 15 °С, если температурный коэффициент
стандартного потенциала
при 15 °С, если температурный коэффициент
стандартного потенциала
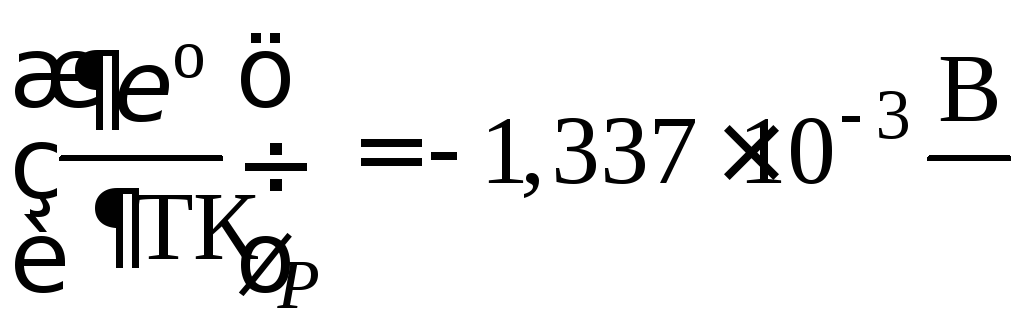 .
.
Вычислить ЭДС термогальванической системы таких электродов при разнице их температур 10 и 20 градусов.
Решение
Электродная реакция на рассматриваемом электроде и стандартный электродный потенциал при температуре 25 °С (298 К) по справочным данным таковы:
![]() ,
,![]() = +0,345 В.
= +0,345 В.
Стандартный потенциал электрода при температуре Т, отличающейся от стандартной, уравнение (10.25)
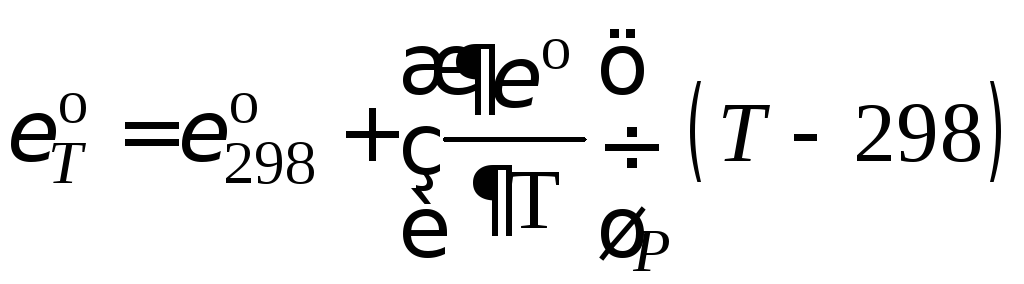 ,
,
поэтому при 15 °С
![]() В.
В.
Термогальванической системой называется гальванический элемент (в общем случае любой ХИТ), составленный из одинаковых электродов, температуры которых разные. В нашем случае это такой гальванический элемент:
![]() .
.
Электродвижущая сила элемента

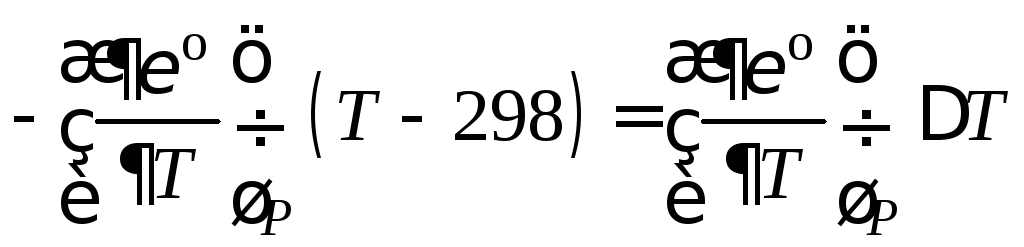 ,
,
поэтому при разнице температур
![]() = 10 °
= 10 °
![]() В,
В,
а при разнице
![]() = 20 °
= 20 °
![]() В.
В.
Знак минус означает, что потенциал «горячего» электрода меньше, чем «холодного» электрода. Другими словами «горячий» электрод является анодом и на нем протекает процесс
![]() ,
,
а «холодный» – катодом с процессом
![]() .
.
Пример 53. Вычислить константу равновесия потенциалобразующей реакции в элементе Даниэля при стандартной температуре.
Решение
Элемент Даниэля
![]()
с электродными процессами и потенциалобразующей реакцией
![]() ,
,![]() = –0,763 В;
= –0,763 В;
![]() ,
,![]() = +0,337 В;
= +0,337 В;
![]() ,
,![]() .
.
По уравнению (10.30) имеем
![]() .
.
Отсюда константа равновесия
![]() .
Такая огромная величина константы
равновесия означает, что, например,
равновесие реакции взаимодействия
металлического цинка с водным раствором
.
Такая огромная величина константы
равновесия означает, что, например,
равновесие реакции взаимодействия
металлического цинка с водным раствором![]()
![]()
сильно сдвинуто вправо, другими словами реакция идет до конца (полного расходования одного из исходных реагентов).
Пример 54. Потенциалобразующая реакция гальванического элемента Вестона
![]() .
.
Определить электродные реакции, условные записи электродов и гальванического элемента. Написать уравнения Нернста для электродных потенциалов и ЭДС элемента. Вычислить изменения энергии Гиббса, энтальпии и энтропии для потенциалобразующей реакции для температуры 35 °С. Известно, что для элемента Вестона температурный коэффициент равен –4,06·10–5В/К.
Решение
Согласно уравнению реакции активными
веществами элемента являются металлический
кадмий Cd, ртутьHgи труднорастворимая соль![]() ,
произведение растворимости
,
произведение растворимости![]() = 6,4·10–7(моль/л)3. Электролитом
является водный раствор соли
= 6,4·10–7(моль/л)3. Электролитом
является водный раствор соли![]() .
Один из электродов поэтому является
.
Один из электродов поэтому является
![]() ,
,
стандартный электродный потенциал
которого при 25 °С по справочным данным
![]() = –0,403 В. Другой, ртутно-сульфатный
электрод
= –0,403 В. Другой, ртутно-сульфатный
электрод
![]()
имеет стандартный потенциал
![]() .
Поэтому на электродах элемента Вестона
протекают:
.
Поэтому на электродах элемента Вестона
протекают:
анодная реакция ![]() ,
,
катодная реакция ![]() .
.
Условная запись гальванического элемента Вестона
![]() .
.
По уравнению Нернста электродные потенциалы анода и катода
![]() ,
,
![]() ,
,
а электродвижущая сила элемента
![]() .
.
Электродные потенциалы и ЭДС зависят
от температуры и концентрации электролита.
При температуре 35 °С (308 К) ЭДС
элемента Вестона, если
![]()
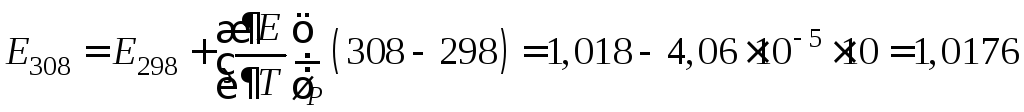 В.
В.
Тогда изменение энергии Гиббса для потенциалобразующей реакции элемента Вестона
![]() .
.
Из уравнения (10.32) находим тепловой эффект реакции
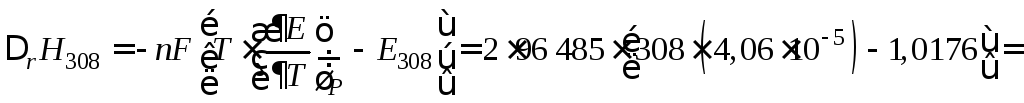 = –198 760 Дж или –198,8 кДж.
= –198 760 Дж или –198,8 кДж.
Изменение энтропии вычисляем по уравнению (10.33)
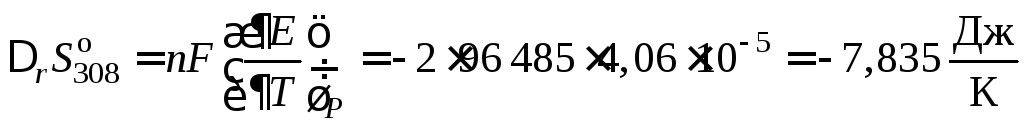 .
.
Пример 55. Тепловой эффект реакции при 298 К
![]() ,
,![]() = –94 200 Дж.
= –94 200 Дж.
В каком гальваническом элементе протекает эта реакция? Рассчитайте ЭДС элемента, если экспериментально определенное повышение ее при нагревании равно 1,45·10–4В/К.
Решение
Из уравнения (10.33) следует
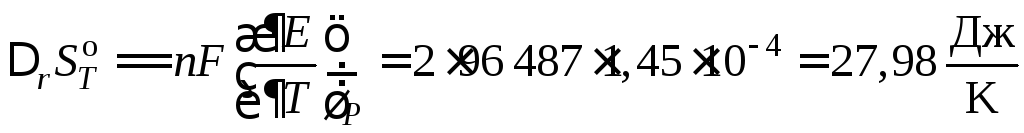
гальванический элемент состоит из свинцового и каломельного электродов
![]()
Анодная реакция ![]() .
.
Катодная реакция ![]() .
.
Суммарная реакция ![]() ,
,
изменение энергии Гиббса для которой
![]() .
.
Следовательно,
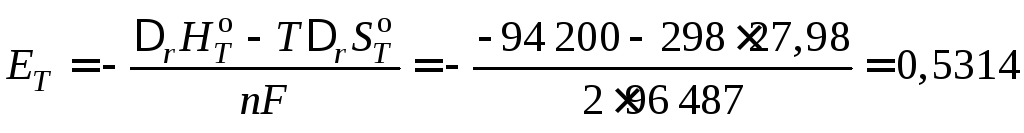 В.
В.
Пример 56. В гальваническом элементе
![]()
цинковый и
хлорсеребряный электроды находятся в
одном электролите – водном растворе
хлорида цинка с концентрацией соли
0,005 моль/л и средним коэффициентом
активности
![]() =
0,789. Температура 298 К. Вычислить ЭДС
элемента, если стандартные электродные
потенциалы
=
0,789. Температура 298 К. Вычислить ЭДС
элемента, если стандартные электродные
потенциалы![]() = –0,763 В,
= –0,763 В,![]() = +0,222 В.
= +0,222 В.
Решение
Анодный процесс
![]() ,
катодный процесс
,
катодный процесс![]() ,
поэтому ЭДС элемента
,
поэтому ЭДС элемента
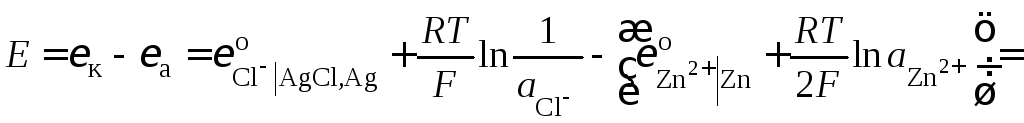
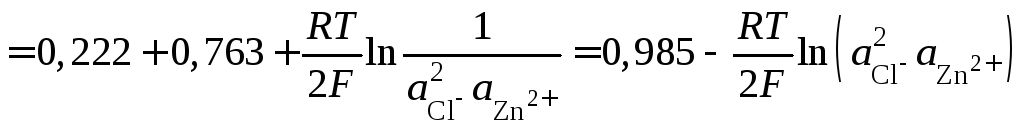 .
.
Так как средняя активность электролита
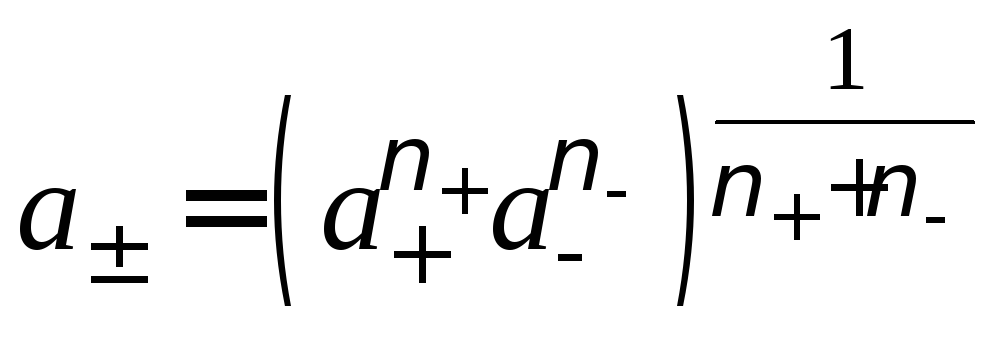 ,
то
,
то![]() .
.
С другой стороны
![]() ,
,![]() ,
,
поэтому для нашего электролита получим
![]() ,
,![]() .
.
Таким образом,
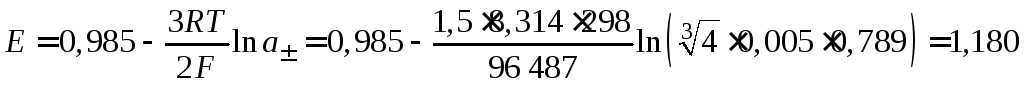 В.
В.
Пример 57. При температуре 298 К ЭДС элемента
![]()
равна 0,624 В. Определить средний коэффициент
активности
![]() .
.
Решение
Электродный потенциал катода (в нашем
случае электрода первого рода
![]() )
определяется уравнением
)
определяется уравнением
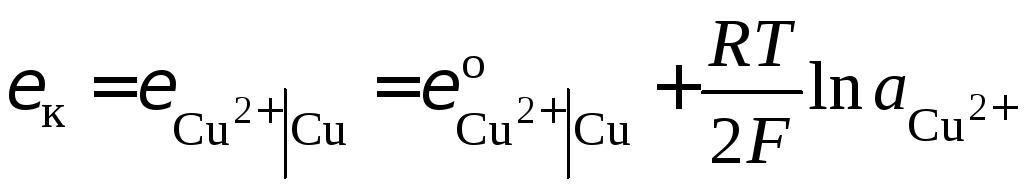 .
.
Электродный потенциал анода (в нашем
случае электрода второго рода
![]() ):
):
 .
.
С учетом табличных значений стандартных
электродных потенциалов
![]() = 0,3391
В,
= 0,3391
В,![]() =
–0,3603 В получим
=
–0,3603 В получим
![]() В.
В.
Отсюда
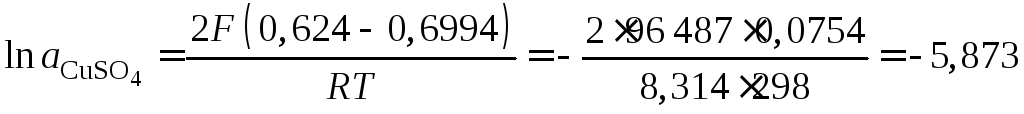 .
.
Следовательно
![]() ,
,
а коэффициент активности электролита
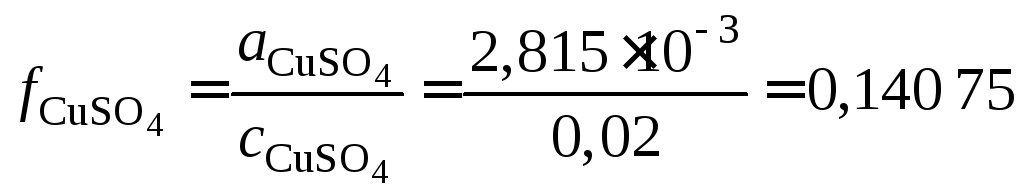 .
.
Тогда средний коэффициент активности
![]() .
.
