
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
8.2. Задачи для самостоятельного решения
134. Написать реакции и вычислить потенциалы при 298 К следующих электродов:
Cd2+|Cd![]() ;
;
Cl–|Cl2,Pt ![]()
Br–|AgBr,Ag ![]() ;
;
Sn2+,Sn4+|Pt ![]()
![]()
![]()
Ответ: –0,4318; 1,4767; 0,2071; –0,1116; 0,6690 В.
135. Написать реакции и вычислить потенциалы при 298 К следующих электродов:
H+|H2,Pt![]()
![]()
![]() ;
;
F–
| F2,
Pt ![]() ;
;
Fe2+,
Fe3+ |
Pt ![]()
Au3+|Au![]() .
.
Ответ: –0,236; 0,445; 1,986; 0,724; 1,201 В.
136. Вычислить при 298 К потенциал электрода
OH–|O2,Pt, если pH=12, а
![]() .
Ионное произведение воды
.
Ионное произведение воды
![]() (моль/л)2.
(моль/л)2.
Ответ: 0,518 В.
137. При температуре 298 К потенциал
электрода Zn2+|Zn
![]() равен –0,82 В. Определить стандартный
потенциал цинкового электрода.
равен –0,82 В. Определить стандартный
потенциал цинкового электрода.
Ответ: –0,761 В.
138. Рассчитать потенциал электрода Fe2+|Feв водном растворе с ионной силой I=0,103. Концентрация ионовFe2+в растворе равна 0,001 моль/л. Использовать при решении закон Дебая–Геккеля, считаяh=0,509.
Ответ: –0,5488 В.
139. Рассчитать ионную силу водного раствора MgSO4при температуре 298 К, если концентрация MgSO41 ммоль/л, а потенциал электродаMg2+|Mgравен –1,642 В. Использовать при решении закон Дебая–Геккеля, считаяh=0,509.
Ответ: 4,0910–3.
140. Определить активность иона Cl–в водном растворе, если потенциал хлорсеребряного электрода равен 0,2289 В.
Ответ: 0,779.
141. Определить pH раствора, если потенциал
водородного электрода при
![]() равен –0,236 В.
равен –0,236 В.
Ответ: 4.
142. Вычислить коэффициент активности иона Cu2+в водном растворе CuSO4с концентрацией 0,02 моль/л, если потенциал медного электрода равен 0,2581 В.
Ответ: 0,9.
143. Вычислить произведение растворимости
AgBr при температуре 298 К. Стандартные
потенциалы
![]() ,
а
,
а![]() .
.
Ответ: 4,910–13(моль/л)2.
144. Вычислить произведение растворимости
PbSO4в воде при
температуре 298 К. Стандартные потенциалы![]() ;
;![]() .
.
Ответ: 2,6910–8(моль/л)2.
145. Металлическая медь взбалтывается с раствором соли двухвалентной меди в отсутствии воздуха при 25 °С. При этом протекает реакция
![]() ,
,
равновесие которой
характеризуется отношением
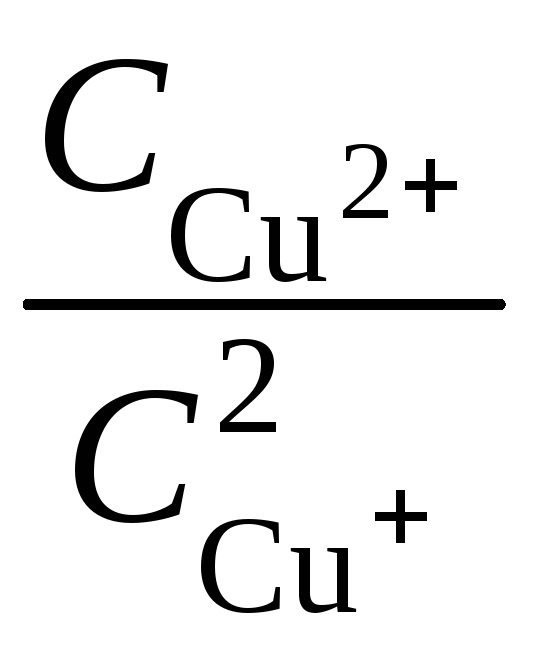 = 2,02·104.
Если стандартный потенциал
= 2,02·104.
Если стандартный потенциал
![]() =0,3391 В, то каков стандартный потенциал
=0,3391 В, то каков стандартный потенциал![]() ?
?
Ответ: 0,4664 В.
146. Электродный потенциал платины в
растворе, в котором
![]() = 106, при 25 °С равен 0,4 В. Вычислить
стандартный потенциал электрода
= 106, при 25 °С равен 0,4 В. Вычислить
стандартный потенциал электрода![]() .
.
Ответ: 0,7548 В.
147. Потенциал медного электрода в
полностью диссоциированном 0,005-молярном
растворе
![]() равен 0,266 В по отношению к стандартному
водородному. Каков потенциал этого
электрода по отношению к насыщенному
каломельному? Вычислить стандартный
потенциал электрода
равен 0,266 В по отношению к стандартному
водородному. Каков потенциал этого
электрода по отношению к насыщенному
каломельному? Вычислить стандартный
потенциал электрода![]() .
.
Ответ: 0,0245 и 0,334 В.
148. Потенциал свинца, помещенного в
0,01-молярный раствор азотнокислого
свинца, по отношению к 1 н каломельному
электроду равен 0,469 В при 25 °С. Кажущаяся
степень диссоциации
![]() равна 62%. Вычислить стандартный потенциал
электрода
равна 62%. Вычислить стандартный потенциал
электрода![]() и сравнить его с табличным.
и сравнить его с табличным.
Ответ: –0,1225 В.
149. Цинковая пластина погружена в 0,1 н
раствор
![]() .
Вычислить на сколько изменится при 25
°С потенциал цинка, если раствор разбавить
в 10 раз. Учесть при расчетах, что для 0,1
н раствора степень диссоциации
.
Вычислить на сколько изменится при 25
°С потенциал цинка, если раствор разбавить
в 10 раз. Учесть при расчетах, что для 0,1
н раствора степень диссоциации![]() = 0,4.
= 0,4.
Ответ: уменьшится на 0,0215 В.
9. Электролиз. Законы Фарадея
Электролиз – это совокупность процессов, протекающих в электрохимической ячейке, при прохождении через нее электрического тока. Количественная оценка электродных процессов при электролизе проводится по законам Фарадея:
количество вещества, участвующего в электрохимических превращениях при электролизе, пропорционально количеству электричества, прошедшего через электролит;
при электрохимическом превращении различных веществ одним и тем же количеством электричества массы полученных продуктов пропорциональны их химическим эквивалентам.
Химический эквивалент – масса вещества, выделившегося при прохождении 1 Кл электричества:
![]() (9.1)
(9.1)
Здесь M– молекулярная масса вещества, г/моль,z– число электронов, участвующих в процессе,F=96485 Кл/моль – число Фарадея.
Согласно законам Фарадея масса вещества, прореагировавшего при электролизе, определяется выражением
![]() (9.2)
(9.2)
где I– сила тока, А;t– время, с; аIt– количество электричества, Кл; отношение![]() называется числом грамм-эквивалентов
(г-экв).
называется числом грамм-эквивалентов
(г-экв).
Число Фарадея F– это количество электричества, необходимое для выделения (разложения) 1 г-экв любого вещества. Оно не зависит от природы вещества, величины тока, формы и материала электрода.
Пониманию законов Фарадея, числа Фарадея и эквивалентной массы способствуют следующие рассуждения. Из анализа катодного процесса разряда водорода
![]() (9.3)
(9.3)
следует, что для разряда одного иона водорода требуется количество электричества, равное заряду электрона
![]()
Для разряда 1 моля ионов водорода (число Авогадро) требуется количество электричества, называемое числом Фарадея
![]()
На практике число Фарадея часто выражают в Ач:
![]()
Эквивалентная масса водорода равна 1, поэтому закон Фарадея для процесса (9.3) запишется:
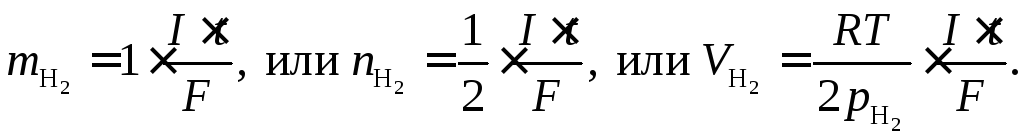 (9.4)
(9.4)
Сравнивая процесс, например, разряда на катоде ионов меди

с процессом разряда водорода (9.3), можно
видеть, что эквивалентным 1 молю ионов
водорода является
![]() моля ионов меди. Поэтому эквивалентная
масса меди равна
моля ионов меди. Поэтому эквивалентная
масса меди равна![]() .
.
При протекании на электроде нескольких электрохимических реакций только часть электричества будет затрачена на каждую из электродных реакций. В законе Фарадея это учитывается введением в уравнение (9.2) доли электричества, приходящегося на конкретную реакцию, которая называется выходом по току, bi:
![]() (9.5)
(9.5)
При использовании законов Фарадея
необходимо, прежде всего, знать какие
реакции протекают на электродах.
Например, при электролизе раствора
CuSO4с инертным платиновым анодом
на нем разряжаются не анионы![]() ,
а ионы OH–
,
а ионы OH–
![]()
При этом диссоциирует вода
![]()
и суммарным анодным процессом является реакция разложения воды с выделением газообразного кислорода:
![]()
При этом в растворе уменьшается концентрация соли, вместо нее появляется серная кислота, концентрация которой увеличивается. На катоде в реальных электролизерах протекают два процесса. Один из них – разряд ионов меди
![]()
и масса получившейся меди определяется законом Фарадея (9.5)

Другой катодный процесс
![]()
являющийся суммой реакции разряда ионов водорода
![]()
и диссоциации воды
![]()
приводит к образованию газообразного водорода. Количество выделившегося водорода (моль)
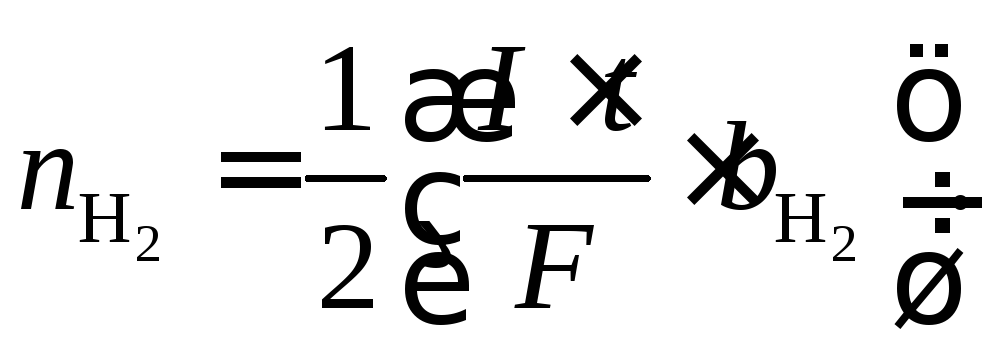
При этом
![]() .
.
