
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
7.1. Примеры решения задач
Пример 34. Сосуд для измерения электропроводности заполнен 0,1 М раствором CuSO4. Площадь каждого электрода 4 см2. Расстояние между ними 0,7 см. Сопротивление слоя раствора между электродами равно 23 Ом. Определить удельную и эквивалентную электропроводность раствора.
Решение
Подставляя в
выражение
= 1/
величину
из уравнения
![]() ,
получаем:
,
получаем:
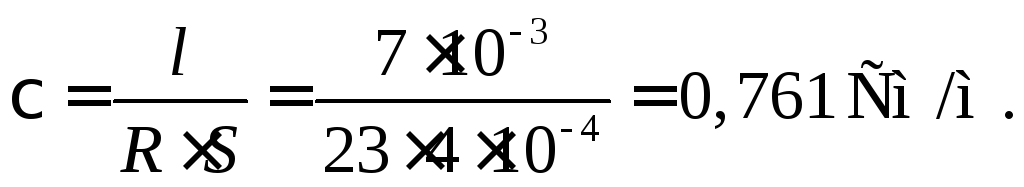
Для
расчета эквивалентной электропроводности
находим молярную концентрацию эквивалентов
раствора CuSO4.
Эквивалентное число соли CuSO4
![]() =12=
2. Поэтому число молей эквивалентов
вдвое больше числа молей CuSO4
и соответственно молярная концентрация
эквивалентов вдвое больше молярной:
сэк
= с
= 20,1
= 0,2 моль (экв)/л. Тогда
=12=
2. Поэтому число молей эквивалентов
вдвое больше числа молей CuSO4
и соответственно молярная концентрация
эквивалентов вдвое больше молярной:
сэк
= с
= 20,1
= 0,2 моль (экв)/л. Тогда
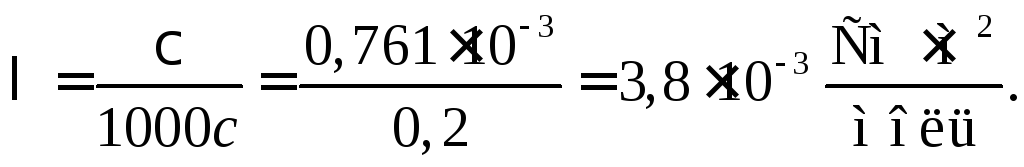
Пример
35. Вычислить
предельную эквивалентную электропроводностьраствора гидроксида аммония NH4OH
при 25С, если значениядля BaCl2, Ba(OH)2и NH4Cl равны
соответственно 120,310–4,
228,810–4и
129,810–4![]() .
.
Решение
Cогласно закону Кольрауша:

Алгебраически суммируя данные выражения, получаем:

Пример 36. Удельная электропроводность 5%-ного (по массе) водного раствора Mg(NO3)2 составляет 4,38 См/м. Плотность раствора 1,0378 г/см3. Каковы эквивалентная электропроводность раствора и кажущаяся степень диссоциации Mg(NO3)2, если при бесконечном разведении эквивалентная электропроводность раствора равна 109,810–4 Смм2/моль?
Решение
Масса 1 л раствора mp = 1,03781000 = 1037,8 г. В нем находится m2=1037,85/100 = 51,89 г соли Mg(NO3)2, молярная масса эквивалентов которой равна М2экв. = 148,3/2 =74,15 г/моль (экв). Тогда молярная концентрация эквивалентов (нормальность)
с= 51,89/74,15 = 0,7 моль (экв)/л = 0,7 н.
Эквивалентная электропроводность раствора
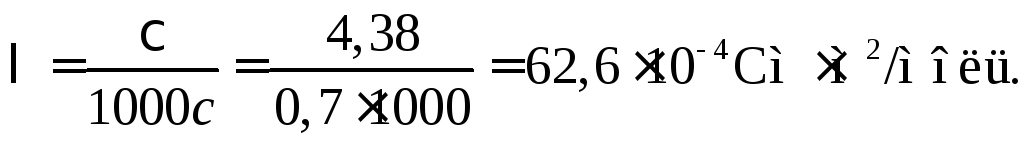
Кажущаяся степень диссоциации

Пример 37. Удельная электропроводность 0,05 н водного раствора уксусной кислоты равна 0,0324, а 0,0001 н раствора CH3COONa –7,7510–4 См/м. Определить константу и степень диссоциации уксусной кислоты в 0,05 н растворе. Предельные электропроводности ионов Na+ и Н+ соответственно равны 50,510–4 и 35010–4 Смм2/моль. Соль считать полностью диссоциированной.
Решение
Вычисляем эквивалентные электропроводности растворов кислоты и соли:

Так
как соль полностью диссоциирована, то
есть
= 1, то
![]() .
.
По закону Кольрауша
![]() .
.
Отсюда
![]() .
.
![]() Смм2/моль.
Смм2/моль.
Тогда степень диссоциации кислоты
![]() .
.
Константа диссоциации кислоты
 ,
,
или 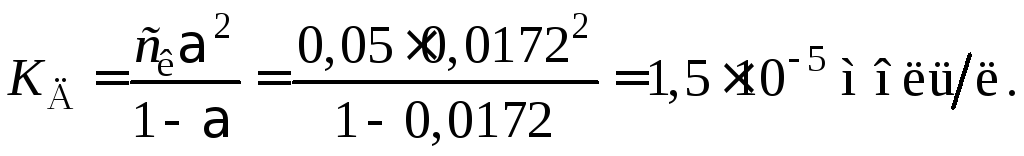
Пример
38. Вычислить
эквивалентную и удельную электропроводность
0,1 н раствора уксусной кислоты при
25 С,
исходя из следующих справочных данных:
константа диссоциации СН3СООН
К
= 1,8510–5
моль/л;
![]() и
и![]() Смм2/моль.
Смм2/моль.
Решение
Вычисляем степень диссоциации СН3СООН, учитывая, что
с/К
= 0,1/1,8510–5
> 100, по формуле
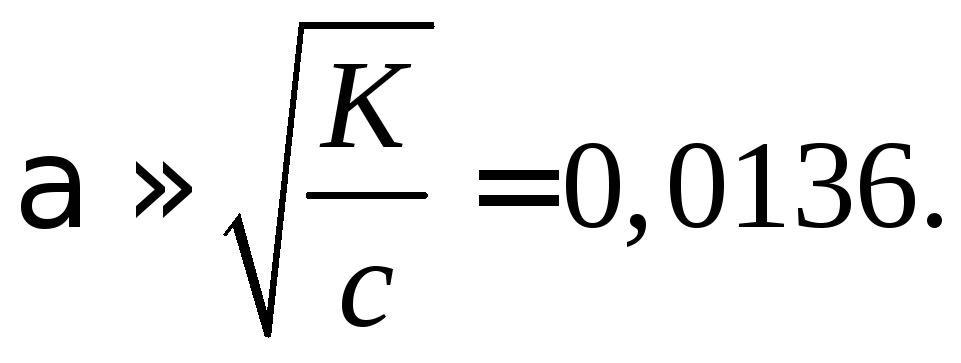
Определяем предельную эквивалентную электропроводность
![]()
Находим эквивалентную электропроводность заданного раствора
=
= 0,0136390,710–4
= 5,3110–4
![]() .
.
Рассчитываем удельную электропроводность
= 1000с = 0,11035,3110–4 = 0,0531 См/м.
Пример 39. Удельная электропроводность насыщенного водного раствора хлорида таллияTlClпри 25С равна 2,410–4См/м. Эквивалентная электропроводность раствора этой соли при бесконечном разведении равна 1,5110–2Смм2/моль. Вычислить растворимостьTlClпри 25С и произведение растворимостиTlCl.
Решение
Для насыщенного раствора справедливо равновесие
TlClнас = Tl+ + Cl
равн. концентрация, моль/л с с
Растворимость соли S=с может быть найдена из выражения
![]() ,
,
представленного в виде

Произведение растворимости соли
L= [Tl+][Cl] = (с)2 = (1,5910–5)2 = 2,5310–10 (моль/л)2.
Пример 40.При электролизе между серебряными электродами раствора, содержавшего 14,055 гAgNO3в 1000 гH2O, выделилось 0,102 г серебра. После электролиза анодное пространство содержало 0,411 г серебра в 40 г воды. Определить числа переносаAg+иNO3–.
Решение
При электролизе между серебряными
электродами идут реакции растворения
анода и осаждения металла на катоде.
Составим материальный баланс по серебру
для анодного пространства: от растворения
анода в раствор переходит количество
серебра (моль)
![]() уходит серебра с током из анодного слоя
к катоду
уходит серебра с током из анодного слоя
к катоду![]()
![]()
![]() Увеличение
количества серебра в анодном пространстве
составляет
Увеличение
количества серебра в анодном пространстве
составляет
 .
.
Это увеличение определим по изменению массы серебра в анодном пространстве в расчете на 40 г воды
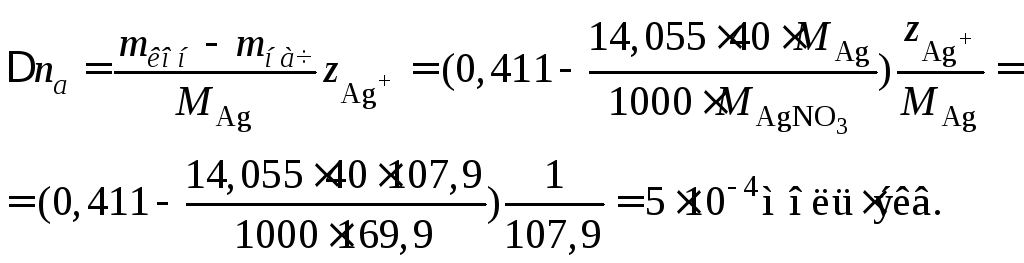
Полагая, что количество растворившегося на аноде серебра равно количеству осадившегося серебра на катоде, получаем для чисел переноса аниона и катиона

![]()
Пример 41.Водный растворNaOHс концентрацией 1 моль/л подвергнут электролизу между платиновыми электродами. После электролиза титрованием установлено, что концентрацияNaOHв катодном слое равна 1,04 н. Объем катодного слоя 50 мл. За время электролиза в последовательно присоединенном серебряном кулонометре выделилось 1,079 г серебра. Найти числа переноса ионов Н+и ОН–.
Решение
При электролизе NaOHмежду инертными платиновыми электродами на аноде идет разрядка ионов ОН–
![]()
а на катоде – восстановление ионов
![]()
![]()
Количество разрядившихся ионов Н+и ОН–(моль экв) пропорционально количеству прошедшего электричества, которое можно найти по массе выделенного в кулонометре серебра
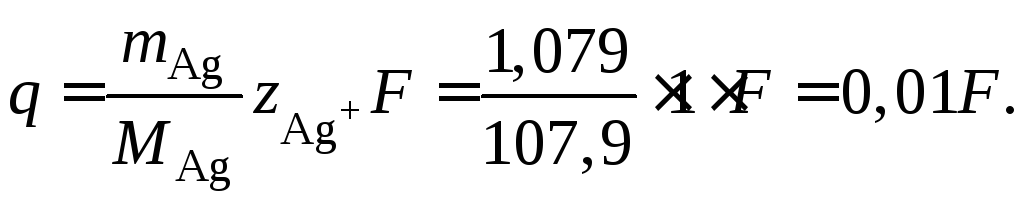
Составим материальный баланс по
количеству ионов ОН–для катодного
пространства, который определяется
увеличением количества ионов ОН–за счет разряда ионов Н+воды на
катоде, пропорциональнымq;
уменьшением количества ионов ОН–за счет ухода ОН–к катоду,
пропорциональным![]() .
Суммарное изменение количества ионов
ОН–в катодном пространстве
.
Суммарное изменение количества ионов
ОН–в катодном пространстве
![]()
и может быть найдено по изменению концентраций раствора NaOHв катодном слое объемомV=50 мл (0,05 л)
![]()
Тогда
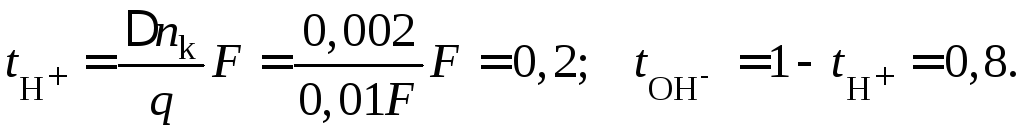
Пример 42.Через
0,1 н водный растворAgNO3пропущен ток между платиновыми
электродами. После прохождения 0,001Fэлектричества титр раствора в анодном
слое уменьшился на 0,0675 г/мл (в расчете
наAgCl) по сравнению с
титром до электролиза. Найти число
переноса![]() в этом растворе.
в этом растворе.
Решение
При электролизе AgNO3между нерастворимыми платиновыми
электродами на катоде восстанавливается
серебро![]() ,
а на аноде идет разрядка ионовOH–воды
,
а на аноде идет разрядка ионовOH–воды
![]()
Уменьшение концентрации AgNO3в анодном слое связано только с уходом к катоду ионов серебра, поэтому
![]() ,
,
Поэтому
![]()
Пример 43.Число переноса иона водорода в 0,05 н растворе НCl(=1) определяли методом движущейся границы. Под действием тока силой 0,003 А граница «прошла» объем раствора, равный 0,159 мл за 311 с. Найти число переноса ионов Н+.
Решение
Из уравнения (7.7) вычисляем число переноса ионов Н+:
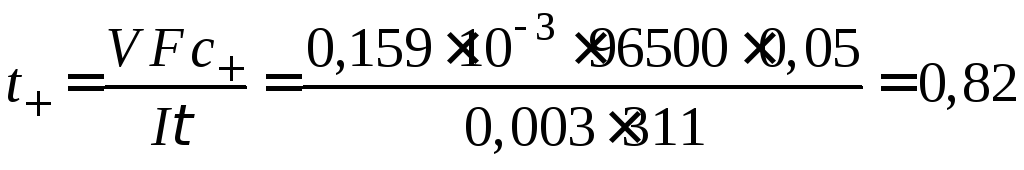 .
.
