
KelinaZagXimiya
.pdf
ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Приклад 2. Описати процеси, які виникають при порушенні нікелевого покриття на залізі у вологому повітрі, та розрахувати ЕРС утвореногокорозійногогальванічногоелемента.
Розв'язання
Залізо покрито нікелем. З таблиць маємо: ϕвFe.п2+ Fe0 = – 0,48 В;
ϕвNi.п2+ Ni0 = – 0,30 В; ϕO2|OH – = +0,82 B.
Нікель– катоднепокриття, томущойогопотенціалбільшдодатний. Припорушеннінікелевогопокриттяназалізівмісціпошкодженнявиникає короткозамкненийкорозійнийгальванічнийелемент
(–)Fe|Fe2+, H2O, O2, OH–|Ni(+),
у якому відбуваються процеси:
А: Fe0 – 2 e → Fe2+;
К: (Ni)O2 + 2H2O + 4 e → 4OH–;
2Fe + O2 + 2H2O → 2Fe(OH)2;
1
2Fe(OH)2 + 2 O2 + H2O → 2Fe(OH)3;
Fe(OH)3 → FeOOH + H2O.
Е = ϕкат.пр – ϕан.пр = ϕO2|OH – – ϕвFe.п2+ Fe0 = 0,82 – (–0,48) = 1,30 В.
При порушенні нікелеве покриття не захищає залізо від корозії, під шаром нікелю в місці пошкодження поширюється корозійний процес та утворюється іржа.
Відповідь: Е = 1,30 В.
Утворення захисних плівок. Стійкі до корозії захисні оксидні та сольові плівки на поверхні металу можна добути обробкою металу певними хімічними реагентами. Цей метод захисту називається пасивацією. Пасивність– цестанпідвищеноїкорозійноїстійкостіметалів абосплавів, якийзумовленийгальмуванняманодногопроцесурозчинення металу. При пасивації має місце значне зміщення потенціалу поверхні металу до додатних значень. Наприклад, для заліза потенціал збіль-
171
С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
шуєтьсявід–0,2...–0,25 до+1,0 В. Пасиваторами, тобторечовинами, які спричиняють утворення захисних плівок, найчастіше є різні окисники: нітратна кислота та її солі, концентрована сульфатна кислота, хромати тощо.
Наприклад, у процесі оксидації на залізо та його сплави наносять хімічним шляхом штучну оксидну плівку Fe3O4 з гарячих лужних розчинів. Вона досить пориста, тому для підвищення її антикорозійних властивостей поверхню просочують мастилом. Плівка надає виробу благородногочорногокольору, томупроцесінакшезветьсяворонуванням і використовується для покриття виробів та деталей, які мають точні розміри: рушниць, пістолетів, вимірювальноїтехніки.
Фосфатування – це хімічний процес утворення нерозчинних фосфатних плівок з антикорозійними властивостями. Для цього використовують суміш манганта ферум-фосфатів в розчині фосфатної кислоти (препарат "Мажеф"). Подібний склад має також перетворювач іржі, який наноситься тонким шаром на іржаву поверхню й утворює на ній нерозчинну плівку фосфатів заліза. Ці плівки використовуються як ґрунт під фарбування. Фосфатування з подальшим фарбуванням вважаєтьсянайбільшекономічнимвисокоякіснимзахиснимпокриттямішироко використовуєтьсявпромисловості.
Електрохімічний захист
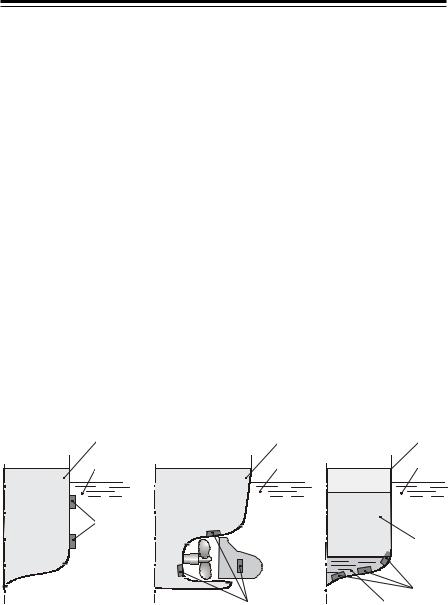
Протекторний захист. Протектор – більшактивнийметал, який приєднується до деталі (корпусу судна) з основного металу (рис. 10).
1 |
1 |
1 |
2 |
2 |
2 |
3 |
|
|
|
|
4 |
|
3 |
3 |
5 |
Рис. 10. Прикладипротекторногозахистусуден:
1 – металева поверхня; 2 – вода; 3 – протектори; 4 – нафта; 5 – підтоварна вода
172
ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Протекторнеповиненшвидкокородувати(розчинятись) тапокриватися продуктами корозії. Найчастіше для захисту залізних споруд використовуються цинк і магній або сплав магнію з алюмінієм та цинком. Радіус дії протектора – біля 50 м. Для захисту 1000 м2 поверхні корпусу судна необхідно поставити 1120 кг цинкових протекторів або 400 кг магнієвих. По мірі розчинення протектори змінюють. Так, на корпусах суден протектори замінюють один раз на рік.
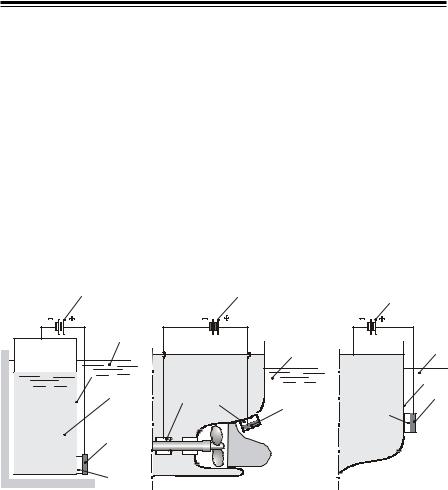
Катодний захист (електрозахист). У цьому способі деталь, яку треба захистити від корозії, приєднують до негативного полюса зовнішнього джерела струму, тобто в електрохімічному колі вона стає катодом (рис. 11). Анодами є металевий брухт, балки та графіт, які поступово кородують. Вони екрановані від деталі, яка захищається (корпуси суден, бурові вежі, стальні опори, нафтопроводи), гумовими екранами. Радіусдіїкатодногозахиступриблизноскладає2000 м, густина струмунакатодідорівнює10–6 А/дм2. Вважається, щоцебільшнадійний захист, ніжпротекторний.
1 |
|
|
1 |
|
1 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
5 |
5 |
|
|
|
|
|
|
4 |
|
|
|
|
4 |
6 |
|
|
|
|
|
4 |
3 |
|
|
2 |
|
|
2 |
|
|||
|
|
|
|
3 |
2
3 |
Рис. 11. Прикладиелектрохімічногозахистуметалевихконструкцій:
1 – джерело струму; 2 – анод; 3 – екран; 4 – деталь, що захищається; 5 – водойма; 6 – нафта
Ці види захисту обов'язково використовуються разом з лакофарбовимипокриттями.
Захист від корозії інгібіторами
Інгібіторикорозії– церечовини, якізменшуютьшвидкістьпроцесу корозії. Вони вводяться безпосередньо в корозійне середовище або
173

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
наносяться на поверхню металу. На даний час відомо понад 5000 інгібіторів.
Широко використовуються інгібітори атмосферної корозії. До них належать, наприклад, моноетаноламін карбонат і дициклогексиламін нітрит. Остання сполука гальмує корозію сталі на п′ять-десять років. Леткіінгібіторивтаблетованомувиглядівикористовуються, наприклад, для захисту внутрішніх поверхонь відсіків подвійних бортів та днищ, де іншізасобинеефективні.
Інгібітори кислотної корозії використовують для захисту металів
укисломусередовищі. Більшістьметалів, особливосплавизаліза, перед покриттямпіддаютьтравленнюдляочищеннявідіржітазняттяоксидної плівки. У цих процесах часто підтравлюється й основний метал. Для запобігання цьому в розчини кислот додають речовини, що утворюють там колоїдні частинки (желатин, декстрин, відходи цукрового виробництва), а також спеціалізовані присадки. Вони утворюють на поверхні металів адсорбційні шари, які запобігають подальшому процесу травлення.
Велике практичне значення має застосування інгібіторів корозії
уводі. На практиці металеві вироби постійно контактують з водою в замкнутихциклах. Водувикористовуютьдляохолодженнядвигунів, як баластнарічковихіморськихсуднах, їїзаливаютьвопалювальнісистеми тощо. Водопровіднатаособливоморськаводасприяютьсильнійкорозії металів, тому для запобігання цій негативній дії широко застосовують інгібітори. Длязахистусталейвикористовуютьуротропін, сумішамоній карбонатутанатрійнітриту, якірозчиняютьутехнологічнійводівпевній концентрації. Сплавимідідобрезахищаєсумішізнатрійбензоатутанатрій нітриту.
Мастила, якими покривають поверхню металу, наприклад під час консерваціївиробу, захищаютьвідкорозіїтимчасово. Дляпідвищенняїх дії до них часто додають інгібітори, наприклад для захисту сталей – моноетаноламін карбонат. Більшість цих речовин розчинна у воді та
увипадкупроникненнявологипідшармастилаутворюєзахиснийрозчин інгібітора. Для кращого їх диспергування в мастила додають також емульгатори.
Легування сталей – уведення до їх складу легуючих компонентів, які здатні утворювати з киснем повітря стійкі захисні оксидні плівки. Як легуючі добавки в металургії використовують нікель, хром, титан, цирконій тощо. За вмістом легуючих інгредієнтів сталі поділяють на
174

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
низьколеговані (менше ніж 5 %), середньолеговані (5...10 %) і високолеговані(більшеніж10 %). Наприклад, стійкавнітратнійкислоті сталь 9Х18Н10Т містить 18 % хрому, 10 % нікелю і 1 % титану. В суднобудуванніпереважновикористовуютьнизьколегованісталімарок 10ХСНД і 09Г2 (містять силіцій, манган, хром та нікель). Вони недостатньостійківморськійводі, томупотребуютьдодатковогозахисту відкорозії.
У табл. 6 наведені деякі методи захисту суднових конструкцій, що мають найбільше застосування в суднобудуванні.
Таблиця6. Методизахистусудновихконструкційвідкорозії
Назва конструкції |
|
Методи захисту |
|
Підводна частина кор- |
Нанесення багатошарового лакофарбового покрит- |
||
пусу |
|
тя; застосування катодного або протекторного |
|
|
|
захисту; використання зварювальних матеріалів, що |
|
Надводні та внутрішні |
леговані нікелем |
||
Нанесення |
багатошарового лакофарбового покрит- |
||
конструкції |
тя, ущільнення зазорів у місцях з′єднання кон- |
||
|
|
струкцій, нанесення металевих покриттів на окремі |
|
Гребні гвинти |
деталі |
|
|
Застосування корозійностійких металів та сплавів, |
|||
|
|
катодний або протекторний захист, часткове засто- |
|
Вузли з різнорідних ме- |
сування металевих покриттів |
||
Нанесення |
лакофарбового покриття та електро- |
||
талів та сплавів |
хімічний захист, електричне роз′єднання з герме- |
||
Танки |
нафтоналивних |
тизацією спряжених поверхонь |
|
Нанесення |
багатошарового лакофарбового покрит- |
||
суден |
|
тя, електрохімічний захист, застосування інгібіто- |
|
Відсіки, |
що підлягають |
рів |
|
Нанесення |
багатошарового лакофарбового покрит- |
||
баластуванню, а також |
тя, інгібіторний захист |
||
подвійне днище |
|
|
|
Запитання та задачі
1.Перелічитиосновніметодизахистувідкорозії.
2.Указатиосновніметодиізоляціїповерхніметалувідкорозії.
3.Охарактеризуватиосновніметодинанесенняметалевихпокрить.
4.Охарактеризуватигальванічніпокриттязазначеннямпотенціалівметалів.
175

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
5.Уякихвипадкахметалевіпокриттязахищаютьосновнийметалвідкорозії припорушеннісуцільностіпокриття, авяких– ні?
6.Пояснитиявищепасивації. Навестиприкладипасиваторів.
7.Охарактеризуватипроцесоксидуваннясталейтаалюмінію.
8.Пояснитихімічніявищаприфосфатуванністалей.
9.Розкритиособливостіелектрохімічногозахисту(протекторногоікатод-
ного).
10.Дативизначенняінгібіторівкорозії.
11.Скластисхемукорозійногогальванічногоелемента, утвореногоприпорушеннімідногопокриттяназалізівморськійводі. Написатирівнянняелектродних процесів. РозрахуватиЕРСі∆G дляцьогоелемента, якщостаціонарніпотенціали залізатамідівморськійводівідповіднодорівнюють–0,50 і–0,08 В.
12.Скластисхемугальванічногоелемента, щоутворюєтьсяприпорушенні
|
|
|
м.в |
|
||
цинковогопокриттяназалізівморськійводі. РозрахуватийогоЕРС, якщо ϕFe2+ |
|
Fe0 |
= |
|||
|
||||||
м.в |
|
|
|
|
||
= –0,50 B; ϕZn2+ |
|
Zn0 |
= –0,8 B; ϕO |OH – = +0,82 B. |
|
||
|
|
|||||
|
|
|
2 |
|
|
|

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Розділ 7. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
Загальні відомості про метали
Більш ніж 80 з відомих у наш час хімічних елементів належать до металевих, прості сполуки яких є металами.
Необхідно чітко розрізняти ці поняття, коли йде мова про фізичні та хімічні властивості елементів-металів і коли розглядаються властивості простих чи складних сполук, що вони утворюють. Атоми елементів характеризуються порівняно невеликим набором фізикохімічних властивостей: зарядом ядра, атомною масою, електронною будовою тощо, які досить повно вивчаються у відповідних розділах загальної хімії. У свою чергу, фізичні та деякі хімічні властивості гомосполук цих елементів зумовлені не тільки будовою їх атомів, але й характером зв'язку між ними та кристалохімічною будовою речовин. Молекулярна форма існування властива металам при високих температурах у парах (Na2, Са2) і визначається наявністю ковалентного неполярногозв'язку. Дляконденсованоїкристалохімічноїформиречовини характерний металевий зв'язок.
Дляметалів– простихречовин– набірфізичнихвластивостейдосить великий: термодинамічні, фізико-механічні, електрофізичні, оптичні, магнітні тощо. До них належать температури плавлення й кипіння, твердістьів'язкість, електроітеплопровідність, непрозорість, пластичність та ін.
Для металів характерні високі теплота електропровідності. Вони зумовлені особливостями металевого зв'язку: у кристалічних решітках металів є відносно вільні електрони, які здатні переміщуватися по кристалупіддієюелектричнихполів. Пластичністьметалів, завдякиякій їхможнакувати, прокатуватиташтампувати, зумовленаненасиченістю й ненаправленістю цього зв'язку. Якщо механічні навантаження на кристалзатомноюструктуроюможутьспричинитирозривковалентних зв'язків і порушення кристала, то у випадку металевого зв'язку такі навантаження приводять лише до зміщення одного шару іонів металу відносноіншого, оскількиприцьомуводночасвідбуваєтьсяперерозподіл електронногогазуікаркаскристалалишаєтьсявелектронномуоточенні.
Укомпактномустанівсіметалинепрозорі, маютьспецифічнийблиск тавідбиваютьсвітловепроміння. Більшістьметалівмаєсірийсріблястий колір з різними відтінками, але декілька металів мають свій особливий
177

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
колір: золото – жовтий, мідь – жовто-червоний, цезій – рожевий. У подрібненомустаніметали, завиняткоммагніюйалюмінію(сріблясті порошки), втрачаютьсвійблискіколір.
Найважливіша хімічна властивість металів – це здатність їх атомів віддаватиелектронизутвореннямкатіонів(елементарниханіонівметали не утворюють). Усі метали в елементарному стані є відновниками.
Існує також невелика кількість елементів, які мають одночасно властивостіметалівінеметалів, – такзванінапівметали(наприклад, Ge, Se, Te, Sb, Tc). Деякіелементиврізнихполіморфнихмодифікаціяхмають різні властивості. Наприклад, біле олово – метал, сіре олово має неметалевівластивості; алмаз– типовийнеметал, графітмаєметалевийблиск іпроводитьелектричнийструм.
Класифікації металів
Метали класифікуються в залежності від їх хімічних і фізичних властивостей, промисловоговикористання, знаходженнявприродітощо.
Зхімічної точки зору всі метали розділяють на дві великі групи
взалежності від будови їх атомів: типові та перехідні. Типовими є s- i p-метали, перехідними – d- i f-метали. Для першої групи характерне заповнення зовнішньої електронної оболонки, для другої – заповнення внутрішніх оболонок. Метали також розділяють на s-, p-, d- i f-метали. У залежностівідхімічноїактивностіметалиподіляютьнадужеактивні, активні, малоактивнійнеактивні(благородні). Вокремігрупивиділяють метали з близькими хімічними властивостями: лужні (Na, K, Rb, Cs), лужноземельні (Са, Sr, Ba), метали підгрупи заліза та ін.
Загальними критеріями фізичних класифікацій металів є густина, температураплавлення, електропровідністьтощо. Так, металиподіляють налегкі(густинаменшеніж5 г/см3) таважкі(густинабільшніж5 г/см3). До легких належать лужні, лужноземельні, алюміній, титан та ін. Найлегший – літій, який має густину 0,53 г/см3 і плаває у воді. Найважчими
єосмій(22,5 г/см3), іридій, платина, реній, вольфрам.
До легкоплавких металів належать ртуть (tпл = –39 °С), галій (tпл = +29 °С), германій та ін. Найбільш тугоплавкі метали – вольфрам (tпл = 3420 °С) і молібден.
Крім ртуті, за звичайних умов усі метали – тверді кристалічні речовини. Серед них найтвердішим є хром (9/10 твердості алмазу), найбільш м'яким – цезій.
178

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Найвищу електропровідність мають метали підгрупи Купруму (срібло, мідь, золото) таалюміній, найменшу– марганець, ртутьітитан.
Утехніці всі метали поділяють на чорні (залізо та його сплави)
ікольорові(всіінші).
Знаходження металів у природі
Усамородномустанізустрічаютьсятількималоактивнітаблагородні метали: золото, платина і платиноїди (рутеній, родій, паладій, осмій та іридій), а також срібло, мідь, ртуть.
Більшістьметалівуприродізнаходятьсявзв'язаномустаніувигляді сполук. Переважніформиїхспецифічнійзалежатьвідактивностіметалів: чим більш активний метал, тим більш яскраво виражений сольовий характер мають його сполуки. Так, лужні метали трапляються у вигляді галогенідів, нітратів, сульфатів, рідко– карбонатів. Усіцісполукидобре розчинніуводі, томуконцентруютьсявморях, океанах, солянихозерах. Копалини на суші (кам'яна сіль NaCl, сильвініт КСl NaCl) утворюються в результаті випаровування водоймищ і мають осадове походження.
Дляменшактивнихлужноземельнихметалівгалогенідитанітратні копалини не характерні, але зустрічаються, наприклад, карналіт СаСl2 МgСl2 6Н2О, норвезька селітра Ca(NO3)2 та ін. Найбільш характернідлянихнерозчиннікарбонати, сульфатитафосфати(вапняк, мармур, крейда СаСО3, доломіт CaCO3 MgCO3, гіпс CaSO4 2H2O, фосфоритCa3(PO4)2 таін.). Багатозцихмінералівєпородоутворюючими, наприклад із доломіту складаються Доломітові Альпи.
Знаходження в природі алюмінію зумовлено його високою спорідненістюдокисню, амфотерністюйогосполукіздатністюдоутворення комплексів. Унаслідокцьоговінутворюєпоширенийкласалюмосилікатів. Продуктамиїхрозкладуєоксидно-гідроксиднікопалини: бемітАlООН,
каолінAl2O3 2SiO2 2H2O, бокситAl2O3 xH2O, кріолітNa3[AlF6].
Для олова, свинцю й більшості перехідних металів найбільш характерні багаточисленні та різноманітні оксидно-сульфідні копалини. Сульфіди утворюють поліметалеві руди, які містять сполуки багатьох металів і мають осадове, гідротермальне й магматичне походження.
У вигляді оксидів або гідроксидів металів трапляються магнітний залізняк(магнетит) Fe3O4, червонийзалізняк(гематит) Fe2O3, рутилTiO2 та ін.; у вигляді подвійних оксидів – хромистий залізняк FeO Cr2O3, ільменітFeO TiO2 тощо. Ізсульфідів, якіможутьбутиразомзарсенідами,
179

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
поширенимиєміднийблискСuS, цинковаобманкаZnS, кіноварHgS, пірит FeS2, мідний колчедан СuS FeS та ін.
МеталипоширенінаЗемлінерівномірно. Масовікларкидеякихіз них дорівнюють кільком процентам: Al – 8,8 %, Fe, Ca – 5,1 %, Na – 2,6 %.
До поширених металів земної кори належать також K, Mg i Ti. Усі інші
метали– рідкі, їхзагальначасткавлітосферіЗемліскладаєвсього0,6 %.
Так, вміст Сs складає 9 10–5 %, Re – 9 10–9 %, Ce – 5 10–4 %, для інших лантаноїдіввінщеменший.
Другою характеристикою, яка відображає поширеність металів
уприроді, є їх здатність концентруватися та утворювати копалини. Так, загальний вміст міді на Землі становить 3 10–3 %, тобто досить малий. Але мідь відома людству з давніх часів, що зумовлено її здатністю кон-
центруватися та утворювати власні копалини. З іншого боку, германій (2 10–4 %) неутворюєвласнихкопалин, азустрічаєтьсяувиглядідомішок
уполіметалевих рудах і деяких вугіллях. Він і багато інших металів (Li, Rb, Cs, Be, Ga, метали підгрупи скандію, всього біля 40 елементів) є розсіяними.
Мінералитагірськіпороди, щомістятьметалитавикористовуються для їх добування, називаються рудами. Звичайно руди – це сукупність мінералів. Мінерали, які містять метал, називаються рудними мінералами, всі інші – пустою породою. Пуста порода найчастіше складаєтьсязпіску, глини, вапняку.
Убагатьохрудахпустоїпородитакбагато, щодобуватиметалз них економічноневигідно. Такірудипопередньозбагачують: відокремлюють віднихчастинупустоїпороди. Найчастішевикористовуютьфлотаційний, гравітаційнийімагнітнийспособизбагачення.
Добування металів
Добування простих речовин з їх природних сполук – це завжди окисно-відновний процес. Усі метали, крім самородних, знаходяться
вприродівокисненомустані. Загальнийпринципїхдобуваннязприродних сполуктакий: чимбільшактивнийметал, тимбільшенергійнийвідновник необхідновикористовуватидляйоговилучення. Типовимивідновниками
вметалургії є водень, карбон, активні метали, електричний струм. Основнимиспособамидобуванняметалівізрудєпірометалургія, гідрометалургія та електрометалургія.
Пірометалургія – спосіб добування металів відновленням їхніх
180
