
KelinaZagXimiya
.pdf
ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Вплив концентрації. Порядок і молекулярність реакції
Залежність швидкості реакції від концентрації реагуючих речовинописуєтьсякінетичнимрівнянням, якевизначаєтьсяекспериментально. Кінетичне рівняння залежить від механізму реакції, тобто від того, через які стадії відбувається даний процес. Якщо реакція відбувається в одну стадію, вона називається простою. Найчастіше реакції є складними, тобто перетворення вихідних речовин у кінцеві проходить через ряд елементарних стадій. Для простих реакцій чи елементарних стадій справедливий закон діючих мас:
приcталійтемпературішвидкістьхімічноїреакціїпрямопропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють їх стехіометричним коефіцієнтам.
У загальному вигляді для складних реакцій типу
aA + bB → Сс+ dD
кінетичнерівняннямаєвиглядv = kCАnАCBnВ, деСА іСВ – концентрації компонентів А і В; nA і nB – порядки реакції за компонентами А і В; k – константа швидкості реакції, яка чисельно дорівнює швидкості реакції при концентраціях реагуючих речовин чи їх добутку, що дорівнює 1; значення k не залежить від концентрацій реагуючих речовин і є сталим при сталій температурі.
Порядком реакції за даним компонентом називається показник степеня при концентрації цього компонента в кінетичному рівнянні. Загальний порядок реакції n дорівнює сумі порядків реакції за окремими компонентами:
n = nA + nB.
Наприклад, для реакції Н2 + І2 → 2НІ, яка є простою реакцією першогопорядкузаН2 таІ2, сумарнийпорядокдорівнює2, кінетичне рівняння має вигляд
v = kCH2 CI2 .
Для складних реакцій кінетичне рівняння не відповідає стехіометричному. Так, для реакції 2N2O5 → 4NO2 + O2 кінетичне рівнян-
91

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
ня таке: v = k[N2O5]. Реакція відбувається через дві послідовні стадії:
N2O5 → N2O3 + O2;
N2O5 + N2O3 → 4NO2.
Перша стадія, більш повільна, лімітує швидкість усієї реакції та визначає її перший порядок за N2O5.
Числомолекул, якіберутьучастьвелементарномуактіхімічного перетворення, називається молекулярністю. Так, перша стадія – мономолекулярна, друга – бімолекулярна. Для простих реакцій порядок і молекулярність збігаються, для складних – не збігаються.
Приклад 1. Визначити вигляд кінетичного рівняння для реакції вгазовійфазіA + B + 2D → F + L, якщопризбільшенніконцентрації СА в два, три, чотири рази швидкість реакції v збільшилась у два, три, чотири рази, при такому ж збільшенні CB не змінилась, а CD – збільшиласьучотири, дев'ять, шістнадцятьразів. Якзмінитьсяшвидкість реакції при збільшенні тиску в два рази?
Розв'язання
З умов задачі виходить, що v залежить прямо пропорційно від CA, незалежитьвідCB іпропорційнаквадратуCD, тобтоv = kCA1CB0CD2. Отже, цей процес є реакцією першого порядку за A, нульового – за B, другого – за D. Загальний порядок реакції дорівнює 1 + 0 + 2 = = 3.
Припідвищеннітискувдваразиконцентраціякожноїречовини в газовій фазі зростає в два рази. Тоді
v2 |
= |
k(2CA )1(2CB )0 (2CD )2 |
= 2 22 = 8. |
|
v1 |
kC1 C 0 C2 |
|||
|
|
|||
|
|
A B D |
|
Відповідь: кінетичне рівняння має вигляд v = kCA1CB0CD2; швидкість реакції збільшується у вісім разів.
Вплив температури
У більшості випадків швидкість реакції зростає при підвищенні температури. Згідно з правилом Вант-Гоффа, при збільшенні темпе-
92

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
ратури на кожні 10 °С швидкість реакції збільшується в два-чотири рази, тобто
γ = |
kt+10 |
= |
vt+10 |
= 2...4. |
|
k |
v |
||||
|
|
|
|||
|
t |
|
t |
|
Правило Вант-Гоффа можна також виразити рівнянням
vt |
|
|
τt |
|
t2 −t1 |
|
||
|
= |
= γ |
10 |
, |
||||
v |
2 |
τ |
|
1 |
||||
t |
|
|
t |
2 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
де γ – температурний коефіцієнт швидкості реакції, який показує, в скільки разів підвищується швидкість реакції при збільшенні температури на кожні 10°.
Приклад 2. Визначити, в скільки разів збільшиться швидкість реакції при збільшенні температури на 40 °С, якщо температурний коефіцієнт швидкості цієї реакції дорівнює 3.
Розв'язання
ЗгіднозправиломВант-Гоффарозраховуємовідношенняшвид- костей при збільшенні температури:
vt |
|
t2 −t1 |
|
40 |
|
|
= γ 10 |
= 310 = 34 = 81. |
|||||
2 |
||||||
vt |
||||||
|
|
|
|
|
||
1 |
|
|
|
|
|
|
Відповідь: швидкість реакції збільшиться у 81 раз.
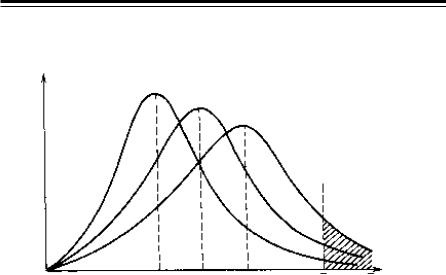
Відповіднодомолекулярно-кінетичноїтеоріїгазівтарідин, кількістьзіткнень частинокугазовійсумішіпритиску101,325 кПаітемпературі 300 Кдосягає 1028 насекунду. Якщобкожне такезіткнення приводило до хімічної взаємодії, то всі реакції відбувалися б миттєво. З цього можна зробити висновок, що не кожне зіткнення приводить до взаємодії. Тільки молекули, які мають певний запас енергії, що називається енергією активації Еа, або мають більшу за неї енергію, беруть участь у хімічному процесі. Крім того, чим більше температура, тим більша кількість молекул досягає енергії активації. Якщо на осі ординат відкласти відношення кількості молекул ∆N, що мають енергію в інтервалі ∆Е, до загальної кількості молекул, то можна буде спостерігати певний розподіл молекул за енергіями
93
С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
в системі в залежності від температури (розподіл Максвелла–Боль- цмана) (рис. 5).
∆N
∆E
T1 < T2 < T3
T1 |
T2 |
T3 |
0 |
E1 |
E2 |
E3 |
Ea |
E |
Рис. 5. Розподіл молекул за енергіями з підвищенням температури
Максимумнакривійвідповідаєймовірнійсереднійенергіїчастинок при даній температурі. Таку енергію має найбільша кількість молекул, і тільки незначна їх кількість має енергію, що дорівнює Еа і вище за неї. При збільшенні температури частка цих частинок зростає при однаковій загальній їх кількості.
Таким чином, швидкість реакції визначається кількістю частинок, якімаютьенергіюЕ≥ Еа, тобтоенергіяактивації– цемінімальна енергія, достатня для здійснення акту хімічної взаємодії.
Залежністьконстантишвидкостівідтемпературивстановлюється рівнянням Арреніуса
k = A e − Ea / RT ,
деА– передекспоненціальниймножник, якийхарактеризуєзагальне числоспівударівмолекул, сприятливихупросторовомувідношенні; Еа – енергія активації, Дж/моль; Т – абсолютна температура; R –
універсальна газова стала; e− Ea / RT – частка активних зіткнень. Збільшення швидкості реакції з підвищенням температури по-
в'язане зі зростанням числа активних молекул.
94

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Приклад3. Розрахуватиенергіюактиваціїреакції, якщопритемпературі Т1 = 273 К константа k1 = 4,04 10–5 c–1, а при T2 = 280 К k2 = 7,72 10–5 c–1.
Розв'язання
Використовуємо рівняння Арреніуса:
|
|
|
|
k |
E |
a |
1 |
|
1 |
|
|
|
k |
|
E |
a |
(T |
−T ) |
|
|||||||
|
|
ln |
|
2 |
= |
|
|
|
|
− |
|
|
|
; |
lg |
2 |
|
= |
|
2 |
1 |
; |
||||
|
|
|
|
|
|
|
|
|
T2 |
|
k1 |
19,15T2T1 |
||||||||||||||
|
|
|
|
k1 |
|
R |
T1 |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
R = 8,3 Дж/(моль К); lnA = 2,3 lgA; |
|
||||||||||||||||||||
|
|
|
k |
|
|
|
|
|
19,15 lg |
7,72 |
10−5 |
273 280 |
|
|
||||||||||||
|
19,15 lg |
2 |
TT |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
4,04 |
10−5 |
|
|
||||||||||||||||||||
|
|
|
k |
|
1 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Ea = |
|
|
1 |
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=58750 Дж/моль. |
|||
T2 |
−T1 |
|
|
|
|
|
|
|
|
|
280 |
−273 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Відповідь: енергія активації дорівнює 58750 Дж/моль.
Вплив каталізатора
Збільшення швидкості хімічної реакції під впливом специфічних речовин, кількість яких не змінюється, називається каталізом. Речовини, якізбільшуютьшвидкістьреакції, називаютьсякаталізаторами, а ті, що вповільнюють, – інгібіторами. Каталізатори беруть участь у реакції, алеврезультатівсіхперетвореньзалишаютьсявхімічнонезмінному стані.
Хімічнийпроцесуприсутностікаталізаторавідбуваєтьсяіншим шляхом, який характеризується меншою енергією активації, що й пояснює збільшення швидкості реакції. Якщо реагенти, каталізатор і проміжні сполуки знаходяться в одній фазі, мова йде про гомогенний каталіз; якщо реагенти та каталізатор знаходяться в різних фазах, а проміжні сполуки утворюються на межі поділу фаз – про гетерогенний каталіз.
Запитання та задачі
1.Що називається швидкістю хімічної реакції?
2.Як описується залежність швидкості реакції від концентрацій реагуючих речовин для простих і складних реакцій?
95

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
3.Що таке порядок і молекулярність реакції? Коли вони тотожні?
4.Дати визначення константи швидкості хімічної реакції.
5.Сформулювати правило Вант-Гоффа. Навести рівняння Арреніуса. Чому швидкість реакції збільшується з підвищенням температури?
6.Що таке каталіз? Яка його суть?
7.Визначити температурний коефіцієнт швидкості реакції розкладу
мурашиної кислоти на СO2 і H2 в присутності каталізатора, якщо константа швидкості при 413 К дорівнює 5,5 10–4 c–1, а при 458 К дорівнює
9,2 10–3 c–1.
8.Енергія активації реакції N2O5 → N2O4 + 0,5O2 дорівнює 103,5 кДж/моль. Константа швидкості цієї реакції при 298 К дорівнює 2,03 10–3 c–1. Розрахувати константу швидкості реакції при 288 К.
4.3.Хімічна рівновага
В основному хімічні реакції є оборотними, тобто можуть одночасно проходити в двох взаємно протилежних напрямках. Коли швидкості прямої та зворотної реакцій стають рівними, в системі встановлюється хімічна рівновага, яка при даній температурі характеризується константою рівноваги (KС або KP). Так, для реакції
аА + bВ →← fF + dD константа рівноваги виражається рівнянням
KC = |
[F ] f [D]d |
. |
|
[A]a [B]b |
|||
|
|
Відповідно до закону діючих мас константа рівноваги будь-якої (простої чи складної) оборотної реакції – величина стала при сталій температурі. Вона може бути розрахована, якщо відомі вихідні концентрації речовин і рівноважна концентрація одного з реагентів.
Приклад. Для реакції A + 2B →← L + 3M вихідні концентрації становлять: СA = 2 моль/л; СB = 3 моль/л, арівноважнаконцентрація [L] = 0,5 моль/л. ВизначитиKС (загальнийоб'ємзалишаєтьсясталим).
Розв'язання
З рівняння реакції видно, що 0,5 моля L отримується з 0,5 моля A і 1 моля B; при цьому утворюються 1,5 моля M. Тоді при досягненні рівноваги рівноважні концентрації будуть становити: [A] =
96

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
=2 – 0,5 = 1,5 моль/л; [B] = 3 – 1 = 2 моль/л; [L] = 0,5 моль/л; [M] =
=1,5 моль/л.
Отже,
KC = |
[L][M]3 |
= |
0,5 (1,5)3 |
= 0,28. |
|
[A][B]2 |
1,5 22 |
||||
|
|
|
Константу рівноваги можна виразити і через парціальний тиск.
Так, для реакції N2(г.) + 3H2(г.) →← 2NH3(г.)
KC = |
[NH3 ]2 |
|
; KP = |
PNH2 |
3 |
. |
|||||
|
]3 |
|
|
||||||||
|
[N |
2 |
][H |
2 |
|
P |
P3 |
2 |
|
||
|
|
|
|
|
N2 |
H |
|
||||
Зв'язок між KС і KР установлюється рівнянням KP = KC(RT)∆n, де ∆n – зміна числа газоподібних молекул у реакції.
Константа рівноваги пов'язана зі стандартною зміною енергії Гіббса реакції рівнянням
∆Gr0 = –RTlnK.
Якщо відома зміна енергії Гіббса реакції, це співвідношення дозволяє розрахувати константу рівноваги та навпаки.
Принцип ле Шательє
Якщо на систему, що знаходиться в рівновазі, подіяти зовнішнім фактором, то в ній виникнуть процеси, які зменшать цей вплив. Наприклад зміна температури змінюєK таким чином: її підвищення зміщує рівновагу в бік ендотермічної реакції, зниження – у бік екзотермічної. Зміна тиску при ∆n ≠ 0 зміщує рівновагу газових реакцій: підвищення – в напрямку процесу, який супроводжується зменшенням числа молекул газів (об'єму), зниження – у бік збільшення числа молекул газів (об'єму).
Уведеннякаталізаторівурівноважнусистемунеможевикликати зміщення рівноваги, томущокаталізатор, прискорюючи одночасно іпряму, ізворотнуреакції, прискорюєпроцесдосягненнярівноваги.
97

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
Запитання та задачі
1.Що таке хімічна рівновага? Дати визначення константи рівноваги, пояснити її зв'язок з енергією Гіббса.
2.Написати вираз закону діючих мас для реакцій:
→ |
+ 3H2 |
→ |
→ |
2NO + O2 ← 2NO2; N2 |
← 2NH3; H2CO3 |
← H2O + CO2. |
3. Сформулювати принцип ле Шательє. Як збільшити вихід SO3 в ре-
акції SO2 + O2 →← 2SO3; ∆H0r = –179 кДж?
4. Об'ємний склад реакційної суміші в момент рівноваги для реакції
2СО2(г.) →← 2СО(г.) + О2(г.) був такий: 88,72 % CO2; 7,52 % CO; 3,76 % O2.
Знайти KP і KC для цієї реакції, якщо загальний тиск у системі при температурі 273 К дорівнює 1,01 105 Па.
5. Константа рівноваги системи 2N2 + O2 →← 2N2O дорівнює 1,21. Рівноважні концентрації такі: [N2] = 0,72 моль/л та [N2O] = 0,84 моль/л. Знайти вихідну та рівноважну концентрації кисню. Розрахувати ∆G0 реакції.

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
Розділ 5. РОЗЧИНИ
5.1. Загальні поняття про розчини
Розчинами називаються гомогенні термодинамічно стійкі системи змінного складу, що містять два або більше компонентів, між якими можуть відбуватися фізична та хімічна взаємодії.
Розчиниможутьіснувативбудь-якомуагрегатномустані– твердому, рідкомуабогазоподібному. Спільнаознакадляних– однофазність.
Компонентами розчину є розчинник (середовище) та розчинена речовина (або декілька речовин), яка рівномірно розподілена в розчинникуувиглядімолекул, атомівабоіонів. Розчинникомєречовина, що знаходилась до утворення розчину в тому ж агрегатному стані, що й одержаний розчин у цілому. Якщо агрегатний стан речовин, які складають розчин, до розчинення був однаковий, то за розчинник беруть речовину в надлишку.
Утворення розчинів є процес самовільний, який відбувається зі збільшенням невпорядкованості системи, тобто з підвищенням ентропії (∆S > 0) і зменшенням енергії Гіббса згідно з рівнянням
∆G = ∆Н – Т∆S.
Механізм розчинення в значній мірі залежить від природи розчинникаірозчиненоїречовини. Так, розчиненнявполярнихрідинах (Н2О, NH3) твердихречовинзіонноюструктурою(солі, луги) відбуваєтьсячерезтакістадії: орієнтаціюполярнихмолекулрозчинникабіля іонівповерхневогошарукристалічної решіткиречовини, якарозчиняється, та утворення між ними іон-дипольного зв'язку; руйнування кристалічної решітки твердої речовини, перехід її частинок (іонів) у розчин; фізико-хімічну взаємодію іонів з розчинником з утворенням гідратів або сольватів (після висушування – кристалогідратів).
Розчини займають проміжне положення між механічними сумішами та хімічними сполуками. Як і для механічних сумішей, для розчинів характерні несталість складу в широких межах та можливість виявити багато властивостей їх окремих компонентів. Для розчинів і хімічних сполук притаманні однорідність та наявність при їх утворенні теплових ефектів, зміни об'ємів, а також іноді зміна кольору.
Тепловийефектрозчиненняєхарактернимдлярозчиненняуводі більшостіречовинукристалічномустані, рідинівсіхгазів. Прицьо-
99

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
му загальна зміна ентальпії розчинення ∆Н може бути як додатною (∆H > 0), так і від'ємною (∆Н < 0). Наприклад, розчинення сульфатної кислоти є екзотермічним процесом:
H2SO4(р.) + 200H2O(р.) → H2SO4200H2O(розч.); ∆H = –74,27 кДж.
Прикладом процесу зі зміною об'єму при розчиненні є змішування етанолу С2Н5ОН і води. Об'єм одержаного розчину менший від суми об'ємів вихідних рідин на 3,5 %.
При розчиненні безбарвних кристалів купрум сульфату СuSO4 у воді утворюється розчин блакитного кольору, а при випаровуванні – блакитний осад кристалогідрату складу CuSO4 5H2O.
Способи вираження складу розчинів. Розчинність
Кількісний склад розчину можна виразити концентрацією або часткою. Концентрація – це співвідношення неоднотипних величин. Її одиниця – моль/л, г/л (об'ємні концентрації) або моль/г, моль/кг (масовіконцентрації). Відношенняоднотипнихвеличинназивається часткою. Частка – безрозмірна величина. Розглянемо деякі з цих характеристик:
1. Масова частка ωі – це відношення маси mi розчиненого i-го компонента до cумарної маси розчину Σmi. Її звичайно виражають у частках одиниці або у відсотках:
ωі = mi/ Σmi або ωі = mi/Σmi 100 %.
2. Мольна частка χi – це відношення кількості молів речовини νi розчиненого i-гокомпонентадосумарноїкількості молівречовин усіх компонентів розчину Σνi:
χi = νi/ Σνi.
3. Молярнаконцентрація(молярність, СМ, моль/л) – цевідношеннякількості речовини νi розчиненого i-гокомпонента дооб'ємурозчину V:
CM = νi /V.
Розчини з молярнiстю 1 і 0,1 моль/л називаються одномолярними, децимолярними тощо. Скорочено записують так: 1 M розчин
NaOH; 0,1 M розчин HCl.
100
