
KelinaZagXimiya
.pdf
ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
2. [S2–] – ?
HS |
– → |
+ |
2– |
(ІІ ступінь); K2 |
= |
[H+ ][S2− ] |
. |
||
← H + S |
|
[HS |
− |
] |
|||||
|
|
|
|
|
|
|
|
||
Оскільки [H+] ≈ [HS–] , то K2 = [S2–] = 10–14 моль/л. Відповідь: [H+] = [HS–] = 7,7 10–5 моль/л; [S2–] = 10–14 моль/л.
Для сильних електролітів ступінь дисоціації не відображає істинної частки молекул електроліту, які розпалися на іони. Експериментальноможнавизначититількитакзванийуявний(позірний) ступінь дисоціації αуяв, який завжди менший від істинного ступеня дисоціації. Для врахування сумарного впливу різних факторів, особливо асоціації сольватованих іонів, використовується поняття активності, або ефективної концентрації. Активність пов'язана з істинною концентрацією співвідношенням а= fс, де f – коефіцієнт активності. Для необмежено розбавлених електролітів f = 1.
У рівняннях іонних реакцій формули сильних електролітів записують в іонній формі, слабких –у молекулярній (в іонній формі – тільки в реакціях дисоціації). Речовини важкорозчинні та гази записують у вигляді молекул.
Реакції в електролітах ідуть до кінця лише в тих випадках, коли з розчину виходять ті чи інші іони внаслідок утворення важкорозчинних(CaCO3, BaSO4), малодисоційованих(H2O, CH3COOH), газів (CO2, H2S) або комплексних сполук ([Fe (CN)6]3–).
Приклад 3. Записати рівняння утворення осаду купрум (ІІ) гідроксидупривзаємодіїкупрумсульфатузнатрійгідроксидомуіонному та молекулярному вигляді.
Розв'язання
Молекулярне рівняння:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
повне іонне рівняння:
Cu2+ + SO24– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + SO24–;
скорочене іонне рівняння:
Cu2+ + 2OH– → Cu(OH)2↓.
111

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
Іонний добуток води. Водневий показник
Вода– слабкийелектроліт, якийдисоціюєзутворенняміонівН+ (або точніше Н3О+) і ОН–:
Н2О →← Н+ + ОН– або 2Н2О →← Н3О+ + ОН–.
При 20...25 °С константа дисоціації
Kд = [H+][OH–]/[H2O] = 1,8 10–16.
Ступінь дисоціації води дуже малий, тому концентрація води є практично сталою величиною: [H2O] = const = 1000/18 = 55,5 моль/л.
Тоді Kд[H2O] = 1,8 10–1655,5 = 10–14. Добуток Kд [H2O] називається
іонним добутком води і позначається Kw = [H+][OH–] = 10–14.
У чистій воді [H+] = [OH–] = 10–7 моль/л. При додаванні кислоти збільшується концентрація H+ і зменшується концентрація іонів OH–, при додаванні лугу – навпаки.
Напрактиці дляхарактеристики кислотності (лужності) середовища використовують водневий показник рН = –lg[H+]. Так, у чистій воді [H+] = [OH–] = 10–7, pH = 7, що відповідає нейтральному середовищу; у кислому середовищі [H+] > [OH–], pH < 7; у лужному
[H+] < [OH–], pH > 7.
Взаємозв'язок між значенням pH середовища і концентрацією в ньому катонів H+ такий:
100 |
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
10–9 10–10 10–11 10–12 10–13 10–14 |
|||||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
7 |
8 |
|
9 |
10 |
11 |
12 |
13 |
14 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
збільшення кислотності |
|
|
|
|
|
збільшення лужності |
|
|
|
|||||||
Приклад 4. Визначити рН 0,01 М розчину амоній гідроксиду,
якщо Kд = 1,77 10–5.
Розв'язання
1. α(NH4OH) – ?
NH4OH →← NH+4 + OH–; [OH–] = Cαn,
112

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
де С – молярна концентрація електроліту; α – ступінь дисоціації; n – кількість іонів даного виду, отриманих при дисоціації (у даному випадку n = 1);
α = |
Kд |
= |
1,77 10 |
−5 |
СМ |
10−2 |
= 0,042. |
||
|
|
|
2. [OH–] – ?
[OH–] = 10–2 0,042 1 = 0,42 10–3 моль/л
або
[OH–] = KдСМ =  1,77 10−5 10−2 = 0,42 10–3 моль/л.
1,77 10−5 10−2 = 0,42 10–3 моль/л.
3. pH – ?
pOH = –lg[OH–] = 3,4; pH + pOH = 14; pH = 14 – 3,4 = 10,6.
Відповідь: рН = 10,6.
5.4. Гідроліз солей
Гідролізомсолейназиваєтьсяпроцесвзаємодіїсолейзводою, який приводить до утворення слабкого або нерозчинного електроліту. Гідроліз можна визначити як реакцію обмінного розкладання солі водою або як процес, обернений процесу нейтралізації. Якщо замість води використовується будь-який інший розчинник, процес називається сольволізом.
Гідролізу зазнають солі, до складу яких входять іони слабких електролітів. При цьому катіон солі (відповідний слабкій основі) поляризує молекулу води та зв'язує гідроксильний іон. Вивільнений іон Н+ утворює кисле середовище (рН < 7). Навпаки, аніон солі, відповідний слабкій кислоті, зв'язує іон Н+ води та вивільняє іон ОН–
(рН > 7).
Таким чином, суть гідролізу полягає втому, що катіони абоаніони солей, або обидва види іонів одночасно можуть зв'язувати відповідно іони ОН– або Н+, або ті та інші з утворенням слабкого елек-
113

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
троліту(відповіднооснови, кислотиабоосновитакислотиодночасно).
Приклади сильних і слабких основ наводяться в підрозд. 5.3. Розглянемо гідроліз різних типів солей.
1.Сіль, утворена катіонами сильної основи та аніоном сильної
кислоти (NaCl, K2SO4, NaNO3), гідролізу не підлягає, тому що зворотна гідролізу реакція нейтралізації відбувається до кінця.
2.Сіль, утворена катіоном слабкої основи та аніоном сильної ки-
слоти (AgNO3, NH4Cl, CuSO4), гідролізується за катіоном, при цьому в розчині зростає концентрація іонів Гідрогену. Наприклад:
NH4Cl + Н2О →← NH4OН + HCl; NH+4 + Н2О →← NH4OН + H+, pH < 7.
3. Сіль, утворена катіоном сильної основи та аніоном слабкої ки-
слоти (Na2CO3, K2S, KCN), гідролізується за аніоном, при цьому в розчині зростає концентрація іонів ОН–. Наприклад:
KCN + Н2О →← HCN + KOH;
CN– + Н2О →← HCN + ОН–, рH > 7.
4. Сіль, утворена катіоном слабкої основи та аніоном слабкої ки-
слоти(Al2S3, Fe2(CO3)3, (NH4)3PO4), гідролізується закатіономіаніоном. Наприклад:
Al2S3 + 6Н2О → 2Al(OH)3 + 3H2S;
2Al3+ + 3S2– + 6H2O → 2Al(OH)3 + 3H2S, pH ≈ 7.
У цьому випадку реакція розчину залежить від відносної сили кислоти та основи, які утворюють сіль. Якщо константи дисоціації основи та кислоти приблизно дорівнюють одна одній, реакція розчину буде нейтральною.
Гідроліз солей, утворених слабкими багатоосновними кислотами, відбуваєтьсяступінчасто, переважнозапершимступенем, причому продукти гідролізу є кислі солі. Наприклад,
Na2CO3 + H2O →← NaHCO3 + NaOH,
CO2–3 + H2O →← HCO–3 + OH–, pH > 7.
114

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
НакопиченняврозчинііонівОН– запобігаєподальшомупроцесу гідролізу за другим ступенем.
Сіль, утворена слабкою багатокислотною основою, також гідролізується переважно за першим ступенем з утворенням основних солей:
ZnCl2 + H2O →← ZnOHCl + H2O;
Zn2+ + H2O →← ZnOH+ + H+, рH < 7.
Кількісною характеристикою гідролізу є константа рівноваги. Наприклад, для реакції
KСN + H2O →← KOH + HCN;
CN– + H2O →← OH– + HCN;
[OH− ][HCN] K = [CN− ][H2O] .
Концентраціяводиврозбавленихрозчинахзмінюєтьсянезначно, і її можна вважати сталою величиною. Тоді
|
|
K |
= K[H O] = |
[OH− ][HCN] |
. |
||||||
|
|
|
[CN− ] |
|
|||||||
|
|
г |
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
Вважаючи, що [OH–] = Kw [H+ ] , маємо |
|
|
|||||||||
|
|
K |
|
= |
[HCN]Kw |
= |
K w |
, |
|
||
|
|
г |
[CN− ][H+ ] |
KHCN |
|
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
де KHCN |
= |
[CN − ][H+ |
] |
|
– константа дисоціації слабкої кислоти. |
||||||
[HCN ] |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
У загальному вигляді константа гідролізу солі, утворенї силь-
ноюосновоютаслабоюкислотою, Kг = K w  Kкис , деKкис – константа дисоціації слабкої кислоти.
Kкис , деKкис – константа дисоціації слабкої кислоти.
115

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
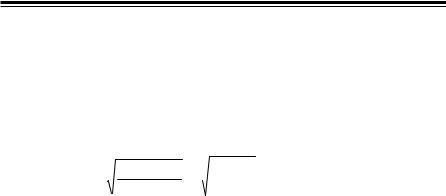
Для гідролізу солі, утвореної катіонами слабких основ та аніонами сильних кислот, Kг = Kw  Kосн , де Kосн – константа дисоціації слабкої основи.
Kосн , де Kосн – константа дисоціації слабкої основи.
Константа гідролізу солей, утворених катіонами слабких основ та аніонами слабких кислот, має вигляд
Kг = |
Kw |
. |
|
KкисKосн |
|||
|
|
Крім того, є ще одна характеристика гідролізу – це ступінь гідролізуβ – відношеннячислагідролізованихмолекулдозагальноїкількості розчинених молекул. Ступінь гідролізу залежить від константи гідролізу (аналогічно закону розбавлення Оствальда), концентрації солі та виражається у відсотках або в частках одиниці. На глибину гідролізу впливають такі ж самі фактори, що й на іонні рівноваги взагалі: температура, концентрація солі та ін.
Приклад. Визначитиступіньгідролізукалійацетатув0,1 Мрозчині та рН цього розчину.
Розв'язання
Реакція гідролізу відбувається за рівнянням
CH3COO– + H2O →← CH3COOH + OH–.
Знайдемо значення константи гідролізу: 1. Kг – ?
KCH3COOH = 1,8 10–5 (довідкові дані).
Kг = Kw/Kкис = 10–14/1,8 10–5 = 5,56 10–10.
2. β – ?
Знайдемо ступінь гідролізу: β = |
K |
г = |
5,56 10 |
−10 |
|
0,1 |
= 7,5 10–5. |
||
|
СМ |
|
||
3. [OH–] – ?
ВихіднаконцентраціяіонівCH3COO–, якігідролізуються, дорівнює молярній концентрації розчину солі СM. Ураховуючи ступінь
116

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
гідролізу β, вважаємо, що утворилось βСM моль/л іонів OH–: [OH–] = βСM = 7,5 10–5 0,1 = 7,5 10–6 моль/л.
4. pH – ?
pОH = –lg[OH–] = 5,12; pH = 14 –pOH = 14 – 5,12 = 8,88.
Відповідь: β = 7,5 10–5; pH = 8,88.
Щоб зменшити процес гідролізу солі, необхідно готувати розчинивисокоїконцентраціїтазберігатиїхпринизькихтемпературах. Рекомендується також додавати до розчину солі надлишок одного з продуктів гідролізу (кислоти або лугу).
5.5. Добуток розчинності
Дорівноважнихналежитьтакожсистема"важкорозчиннийелектроліт – його насичений розчин", наприклад
BaSO4(кр.) →← Ba2+ + SO24–.
Константа рівноваги в цьому випадку має вигляд
|
[Ba2+ ][SO2– |
] |
|
|
K = |
|
4 |
|
= const. |
[BaSO4 |
] |
|
||
|
|
|
||
Знаменник дробу [BaSO4] є сталою величиною, тому
K[BaSO4] = const = [Ba2+][SO24–] = ДP(BaSO4).
У насиченому розчині важкорозчинного електроліту добуток концентраціййогоіонівуступенях, щодорівнюютьстехіометричним коефіцієнтам, приданійтемпературієвеличинастала, якуназивають
добутком розчинності (ДP).
Приклад. Добуток розчинності плюмбум йодиду при 20 °С дорівнює8 10–9. Визначитирозчинністьсолі(моль/лтаг/л) привказаній температурі.
Розв'язання
Нехай розчинність РbІ2 – x моль/л. Ураховуючи рівняння
117
С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
РbІ2 →← Pb2+ + 2I–,
[Pb2+] = х моль/л, а [I–] = 2х моль/л.
Тоді добуток розчинності
ДP(РbІ2) = [Pb2+][I–]2 = х(2х)2 = 4х3.
Розчинність РbІ2
х = 3 |
ДР(РbІ |
2 |
) |
= 3 |
8 10 |
−9 |
моль/л. |
4 |
|
4 |
= 1,3 10–3 |
||||
|
|
|
|
|
|
Оскільки М(РbІ2) = 461 г/моль, то розчинність у грамах на літр
(г/л) складає 1,3 10–3461 = 0,6 г/л.
Відповідь: розчинність РbІ2 у воді дорівнює 1,3 10–3 моль/л, або
0,6 г/л.
Запитання та задачі
1.Щоназивається розчином? Назвати способи вираження кількісного складу розчинів.
2.Якi способи вираження кількісного складу розчину слід вибирати, щоб вони не змiнювались зі змiною температури?
3.Які розчини називаються iдеальними? Сформулювати закони iдеальних розчинiв.
4.Який фiзичний змiст ебулiоскопiчної та крiоскопiчної констант?
5.Визначити масову частку кальцій гідроксиду в 2 н. розчині Сa(OH)2
(β = 1,09 г/мл).
6.До 345 мл 17%-го розчину NaOH (ρ = 1,1 г/мл) додали 500 мл води та одержали розчин густиною 1,04 г/мл. Визначити його молярнiсть, нормальнiсть i масову частку.
7.Скiльки мiлiлiтрiв 0,2 М розчину Н2SO4 необхiдно для нейтралiзацiї 800 мл 0,1 М розчину NaOH?
8.Тиск пари води при 50 °С дорівнює 12334 Па. Визначити тиск пари
води над розчином, який містить 50 г етиленгліколю С2Н4(ОН)2 у 900 г води.
9.При якій температурі буде замерзати водний розчин етилового спирту, якщо його масова частка в розчині складає 25 %?
118

ОСНОВИ ЗАГАЛЬНОЇ ХІМІЇ
10.Розчин 1,05 г неелектроліту в 30 г води замерзає при температурі –0,7 °С. Визначити молярну масу неелектроліту.
11.Що таке ступінь і константа дисоціації? Написати рівняння дисо-
ціаціїтакихсполук: H2SO3, Al(OH)3, K2SO4, Na3PO4, NH4H2PO4, Al(OH)2Cl.
12.Які електроліти належать до слабких і які до сильних?
13.Сформулювати закон розбавлення Оствальда.
14.Що таке позірний ступінь дисоціації?
15.Записати рівняння, яке пов'язує ступінь дисоціації та ізотонічний коефіцієнт.
16.Визначити осмотичний тиск 0,01 н. розчину MgCl2 при 18 °С, якщо позірний ступінь дисоціації цього електроліту дорівнює 66 %.
17.Що таке іонний добуток води та pH? Визначити pH 0,15 н. розчину ацетатної кислоти (Kд = 1,0 10–5) та 0,15 н. розчину HСl.
18.Визначити молярну концентрацію KOH, якщо pH розчину дорів-
нює 10.
19.Константа дисоціації HNO2 дорівнює 5,1 10–6. Визначити її ступінь дисоціації в 0,01 М розчині і концентрацію іонів Гідрогену.
20.Визначити α і концентрацію іонів ОН– у 0,1 н. розчині NH4OH,
якщо Kд = 1,77 10–5.
21.Ізотонічний коефіцієнт розчину, що складається з 178,5 г KВr
в900 г H2O, дорівнює 1,7. Визначити тиск водяної пари над цим розчином при 50 °С, якщо тиск пари чистої води при 50 °С дорівнює 12334 Па.
22.Що називається гідролізом солей?
23.Чим кількісно характеризується гідроліз?
24.Написати реакції гідролізу Al2(SO4)3, Na2SO4, NH4Cl, Fe2S3. Визначити pH розчинів.
25.Чому не існують розчини солей СuCO3, Al2(SO3)3, (NH4)2S?
26.Розрахувати константу та ступінь гідролізу 0,1 н. розчину NH4Cl,
якщо Kд(NH4OH) = 1,8 10–5.
27.Що називається добутком розчинності?
28.РозчинністьAgCl уводідорівнює10–8 моль/л. ОбчислитиДР(AgCl). Як змінюється розчинність AgCl при додаванні 0,1 моля солі NaCl до 1 л розчину?
119

С.Ю. Кельїна, О.Г. Невинський, О.І. Лічко, О.В. Яновська
Розділ 6. ОКИСНО-ВІДНОВНІ ПРОЦЕСИ ТА ЕЛЕМЕНТИ
ЕЛЕКТРОХІМІЇ
6.1. Окисно-відновні процеси
Реакції, якісупроводжуютьсязміноюступеняокисненняелементів,
називаються окисно-відновними (ОВР).
Ступінь окиснення (СО) елемента в сполуці – формальний заряд на атомі елемента, визначений на підставі припущення, що сполука складається з іонів. Величину та знак ступеня окиснення атомів
усполуках визначають за допомогою таких положень:
1.У нейтральних молекулах алгебраїчна сума ступенів окиснення всіхгіпотетичнихіонівдорівнюєнулю.
2.Угомосполукахступіньокисненняатомівдорівнюєнулю.
3.Гідроген в усіх сполуках має ступінь окиснення +1. Виняток становлять гідриди металів, де Гідроген має СО = –1 (NaH, CaH2).
4.Ступіньокисненняелементівпершихтрьохгрупголовнихпідгруп дорівнюєномеругрупи(Na+1, Cа+2, Аl+3).
5.Флуор в усіх сполуках має СО = –1.
6.СтупіньокисненняОксигенувусіхсполуках, задеякимивинятками, дорівнює–2.
7.Максимальний позитивний ступінь окиснення атомів елементів відповідає номеру групи періодичної системи, в якій вони знаходяться. ВиняткомєелементипідгрупиКупруму(Cu, Ag, Au), деступіньокиснення може бути +2 та +3, тобто більший, ніж номер групи, у металів восьмої групи (Fe, Co, Ni, Rh, Pd, Ir, Pt) СО завжди менший, ніж номер групи.
Величина СО зумовлена зміщенням або повним переходом електронів від атома одного елемента до атома іншого й визначається з положень, наведенихвище. Наприклад:
+1 +5 –2 |
+1 |
+6 –2 |
+1 |
+7 –2 |
+4–2 |
+1 –2 |
H3PO4, K2Cr2O7, KMnO4, CO2, H2S.
Поняття ступеня окиснення не слід ототожнювати з валентністю, навіть у тих випадках, коли їхні абсолютні значення збігаються. Валентність визначається числом зв'язків, які утворює даний атом з іншими атомами, тому ця характеристика не має знака і може дорівнюватинулютількидляодноатомнихсполукугазовомустані. Наприклад,
120
