
- •Міністерство освіти і науки україни донецький національний технічний університет методичні вказівки
- •Міністерство освіти і науки україни донецький національний технічний університет методичні вказівки
- •1.1 Теоретична частина
- •Інструкція з техніки безпеки при виконанні лабораторних робот
- •1.2 Експериментальна частина
- •1.3 Звіт
- •1.4 Контрольні запитання
- •Додаток г
- •Додаток д Застосування евм в корозійних дослідженнях
- •1.5 Ситуація
- •Вплив зовнішніх факторів на газову корозію сталі та сплавів
- •2.1 Теоретична частина
- •Додаток б Десятибальна шкала корозійної стійкості металів та сплавів
- •Додаток в Закон росту оксидних плівок
- •Де Δm – збільшення маси зразку за час іспиту τ;
- •2.2 Експериментальна частина
- •2.3 Звіт
- •2.4 Контрольні запитання
- •2.5 Ситуація
- •10.4. Звіт
- •10.5. Контрольні питання
- •Лабороторна робота 3 Захист сталі і сплавів від газової корозії
- •3.1 Теоретична частина
- •3.2 Експериментальна частина
- •10.2 Мета роботи
- •10.3 Експериментальна частина
- •Визначення властивостей корозійностійких неметалевих покрить
- •10.1 Теоретична частина
- •3.2 Звіт
- •3.3 Контрольні запитання
- •3.4 Ситуація
- •Товщина досліджуємого металу, мм 0,1…3,0
- •9.3 Звіт
- •9.3 Контрольні питання
- •9.4 Ситуація
- •4.1 Теоретична частина
- •Прискорені методи корозійних іспитів оцинкованої сталі.
- •9.1 Теоретична частина
- •8.5. Ситуація
- •8.3. Звіт
- •8.4.Контрольні запитання
- •4.2 Експериментальна частина
- •Таблиця 4.1 - Об'ем газу, який виділяється, в залежності від тривалості електрохімічної корозії в розчині електроліту: температура °с; тиск гПа
- •Таблиця 4.2 - Показники електрохімічноі корозії вивчених сплавів у розчині електроліту за .......Рік
- •8.2 Експериментальна частина
- •4.3 Звіт
- •4.4 Контрольні запитання
- •4.5 Ситуація
- •Вплив зовнішніх факторів на електрохімічну корозію сталі та сплавів
- •5.1 Теоретична частина
- •Потенціостатичній метод вивчення корозійноϊ поведінки металевих матеріалів.
- •8.1 Теоретична частина
- •7.3. Зміст звіту
- •7.4 Питання для перевірки
- •7.5 Ситуація
- •7.1.3 Руйнування деревини
- •7.2 Експериментальна частина
- •7.1.2 Корозія бітумів
- •Контрольні запитання
- •Ситуація
- •Захист сталі та сплавів від електрохімічної корозії
- •6.1 Теоретична частина
- •Наслідку протекторного діяння. Для вуглецевої та низьколегованої сталі анодними покриттями є Zn та Cd. Металеві покриття наносять слідуючими методами:
- •Таблиця 1 – Стійкість деяких полімерів до агресивних середовищ
- •Корозія органічних матеріалів
- •7.1 Короткі теоретичні зведення
- •7.1.1 Корозія полімерів
- •Вплив зовнішніх факторів на корозію полімерів
- •6.2 Експериментальна частина
- •6.3 Звіт
- •6.4 Контрольні запитання
- •6.5 Ситуація
- •Необхідно виготувати патентировочну ванну для розплаву 50%
Де Δm – збільшення маси зразку за час іспиту τ;
б) негативний показник зміни маси, г/(м2 год)
де Δm – зменшення маси зразку за час іспиту τ після видалення продуктів корозії
![]()
де Аок – атомна маса окисника, наприклад кисню;
АМе – атомна маса металу;
nме – валентність металу;
nок – валентність окисника.
Глибинний показник, мм/рік – глибина корозійного зруйнювання металу П в одиницю часу τ:
![]()
Якщо корозія рівномірна
![]()
![]()
де ρме – щильність металу, г/см3
13
Швидкість окислення заліза при температурах 700-950°С не залежить від парціального тиску кисню, якщо в окалині присутні оксиди Fез04 і Fе2Оз. При низькому парціальному тиску кисню утворюється тільки оксид FeO і в цьому випадку константа лінейого закону росту плівки пропорційна тиску кисню.
Вплив швидкості руху газів. Вплив швидкості руху газів на швидкість окислення вуглецевої сталі показано на рис.2.4. Вже при малих швидкостях газового потоку досягаються крайові швидкості окислення металу при даній температурі.
Vok,
г/м2ч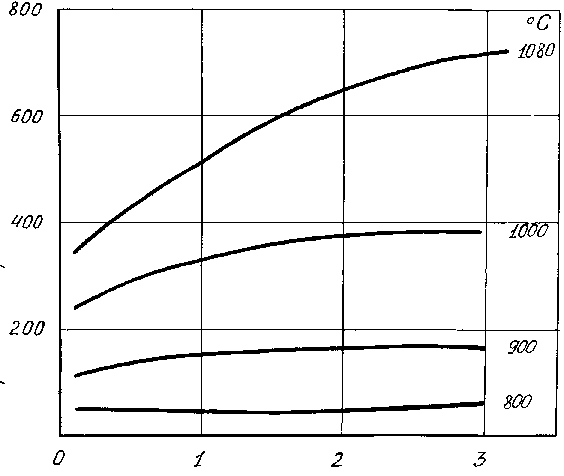
Рисунок 2.4 – Швидкість окислення
високовуглецевої сталі (Vок) в залежності від швидкості руху суміщи газів CO+H2O+N2.
Швидкість руху газів, м/хв
Вплив режиму нагрівання. Коливання температури при нагріванні або експлуатації при високих температурах, зміна нагрівання та охолодження збільшують швидкість окислення заліза та сталей.
2.2 Експериментальна частина
Щоб установити температурну залежність швидкості окислення використовують кілька установок, схема наведена в розділі 1.
Печі попереду нагрівають до температур 800, 900, 1000°С. Зразки маркірують, зачищають по всій поверхні наждачним папером, однієї зернистості, визначають розміри штангенциркулем із точністю 0,1 мм, знежирюють розчинником та зважують на аналітичних терезах.
Потім зразки поміщають у вогнетривкі тиглі, які перевантажують у піч і витримують на протязі заданого часу (0,5-1ч). Перед вигрузкою тиглі із зразками накривають кришками.
14
Після охолодження на повітрі протягом 10-15 хв., а потім в ексикаторі із прокаленим хлористим кальцієм зразки зважують із тиглем і окалиною, потім окремо зважують кожен тигель (без зразків та окалини).
Результати експерименту записують в табл.2.1.
Таблиця 2.1 - Позитивний показник зміни маси зразків із вуглецевої сталі протягом в лабораторній печі із повітряною атмосферою
|
Темпе-ратура, оС |
Роз-мір зраз-ку, мм |
Поверх-ня зразку, S, м2 |
Почат-кова маса, mo, г |
Маса зразка з окали-ною та тиглем, г |
Маса тигля, г |
Маса зразка з окали-ною, г |
Збіль-шення маси, m, г |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Для вивчення залежності швидкості окислення від часу при постійній температурі використовують установку, схема якої наведена на рис. 2.5.
Р исунок2.5
- Схема
установки для вивчення кінетики газової
корозії.
исунок2.5
- Схема
установки для вивчення кінетики газової
корозії.
1. аналітичні терези;
2. ніхромовий підвиє;
3. стіл;
4.екран;
5. кришка печі;
6. піч;
7. зразок;
8. термопара;
9. сигнальна лампа;
10. терморегулятор;
62
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
Шлугер М.А., Ажогин Ф.Ф., Ефимов Е.А. Коррозия и защита металлов.- М.: Металлургия, 1989.- 215 с.
Жук Н. П. Курс теории коррозии и защиты металлов.- М.: Металлургия, 1976.- 472 с.
Защита от коррозии, старения и биоповреждения машин, оборудования и сооружений/под ред. А.А. Герасименко.- М.: Машиностроение, 1987. – 688 с.
Эванс Я. Р. Коррозия и окисление металлов. Пер. с англ.- М.: Машгиз, 1962.- 855 с.
Томашов Н. Д., Чернова Г. П. Коррозия и коррозионностойкие сплавы.- М.: Металлургия, 1973.- 232 с.
Розенфельд И.Л. Атмосферная коррозия металлов. М.: Изд-во АН СССР, 1960.- 372 с.
Защита от коррозии протяженных металлических сооружений/ В.И. Глазков, А.М. Зиневич, В.Г. Котик и др.- М.: Недра, 1969.- 312 с.
Лыков М.В. Защита от коррозии резервуаров, цистерн, тары и трубопроводов для нефтепродуктов бензостойкими покрытиями. – М.: Химия, 1978.- 239 с.
Защита от коррозии конструкций и оборудования металлургических цехов/ В.П. Фишман, И.А. Фрисман, В.А. Сержантов, В.В. Монахов.- Техника, 1983.- 216 с.
Подгорный А.А. Защита подземных металлических трубопроводов от коррозии.- К.: Будівельник, 1988.- 176 с.
Солнцев С.С., Туманов А.Т. Защитные покрытия материалов при нагреве .- М.: Машиностроение, 1976. – 240 с.
Лабораторные работы по коррозии и защите металлов. 2-е изд./ Под ред. Н.Д. Томашова. – М.: Металлургиздат, 1971. – 280 с.
Методические указания к изучению курса «Коррозия и защита металлических материалов»/ Сост.: В.И. Алимов, А.Ф. Котухов. – Доннецк: ДПИ, 1990.
Исаев Н.И. Теория коррозионных процессов. – М.: Металлургия, 1997. – 368 с.
15
Піч нагрівають до заданоі температури (800-1100°С). Пластинчатий зразок із отвором діаметром 1мм готують по методиці, яка була описана вище. Зразок розміщують в печі, яка нагріта до заданої температури, і пидвішують на ніхромовому дротику до чашки терезів.
Через кожні 5-10 хв, протягом однієі години зважують зразок, який окислюється. Під час зважування піч вимикають. Після іспиту зразок витягують із печі. Результати експерименту записують в табл.2.2.
Таблиця 2.2 - Зміна маси зразку із вуглецевої сталі при температурі t°C
Розміри зразку.............................. мм;
Поверхня, S...................................мм^;
Маса, м........................................г.
|
Час витримки від початку, хв |
Маса зразка з ніхромовим тягарем, г |
Маса зразка m2,r |
Зміна маси, г | |
|
∆m=m2-mo, г |
∆m/S, г/м2 | |||
|
1 |
2 |
3 |
4 |
5 |
За даними табл. 2.1. будують графіки температурної залежності LgKm+=f(1/T) знаходять постійні коефіцієнти A тa Q із одержаної емпірічної формули визначають позитивний показник зміни маси для однієї температури і порівнюють його із експериментальним значенням. За даними табл.2.2. будують графік часової залежності. Використовуючи додаток 3, порівнянням визначають закон росту оксидної плівки для заданих умов експерименту і знаходять контролюючий фактор. У висновках коротко оцінюють вплив зовнішніх факторів на газову корозію сталі та сплавів.
16
