
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
2 Процес окиснення
відновник
![]() 3 процес відновлення
3 процес відновлення
окисник

![]()
![]()
При використанні
електронно-іонного балансу треба мати
на увазі: якщо в напівреакції є
незбалансований кисень, то надлишок
кисню в лівій частині напівреакції в
кислому середовищі зв’язується
іонами водню з утворенням молекул води,
а в нейтральних та лужних – молекулами
води з утворенням гідроксид-іонів
![]() .
.
![]() (кисле середовище)
(кисле середовище)
![]() (нейтральне середовище)
(нейтральне середовище)
Нестача кисню у лівій частині напівреакції поповнюється в кислому та нейтральному середовищах киснем з молекул води, при цьому утворюються іони водню, в лужному середовищі – за рахунок гідроксид-іонів з утворенням молекул води. Наприклад:
![]() (нейтральне середовище)
(нейтральне середовище)
![]() (лужне середовище)
(лужне середовище)
Визначимо коефіцієнти за методом електронно-іонного балансу в рівнянні реакції:
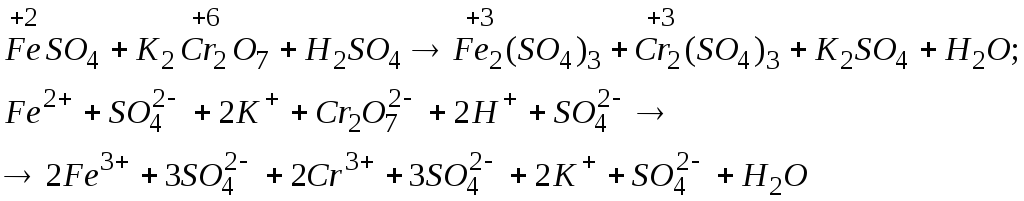
|
відновник |
3 процес окиснення; |
|
окисник
|
1 процес відновлення; |
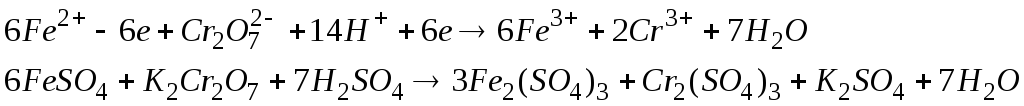
На характер перебігу
окисно-відновних реакцій значно впливає
середовище. Для створення кислого
середовища звичайно використовують
розведену
![]() ,
а лужне середовище створюють, вводячи
в розчин
,
а лужне середовище створюють, вводячи
в розчин
![]() або
або
![]() .
.
Порядок виконання роботи
Дослід 1. Окисно-відновні властивості нітриту натрію.
Узяти дві пробірки. В
першу пробірку влити 3 мл розчину йодиду
калію, додати декілька крапель розведеного
розчину
![]() і розчин
і розчин
![]() до змінення кольору. В другу пробірку
налити 3 мл розчину
до змінення кольору. В другу пробірку
налити 3 мл розчину
![]() ,
підкислити його розведеним розчином
,
підкислити його розведеним розчином
![]() і
додати розчин
і
додати розчин
![]() до утворення безбарвного розчину.
Відзначити зміни.
до утворення безбарвного розчину.
Відзначити зміни.
Дослід
2. Вплив
![]() середовища на окисно-відновні реакції.
середовища на окисно-відновні реакції.
У три пробірки налити
по 3 мл розчину перманганату калію. У
першу додати 2 мл
![]() ,
в другу – 2 мл
,
в другу – 2 мл
![]() ,
в третю – 2 мл
,
в третю – 2 мл
![]() .
У кожну пробірку додати по 3 мл розчину
сульфіту натрію.
.
У кожну пробірку додати по 3 мл розчину
сульфіту натрію.
Оформлення результатів роботи
Дослід 1. Скласти рівняння окисно-відновних реакцій, використовуючи метод електронного або електронно-іонного балансу. Зробити висновок про те, в якому випадку нітрит-іони мають відновні, в якому – окисні властивості.
Дослід
2. Написати рівняння реакцій між
![]() і
і
![]() в кислому, нейтральному і лужному
середовищах, враховуючи, що фіолетовий
колір характерний для іонів
в кислому, нейтральному і лужному
середовищах, враховуючи, що фіолетовий
колір характерний для іонів
![]() ,
слабо-рожевий, майже безбарвний - для
іонів
,
слабо-рожевий, майже безбарвний - для
іонів
![]() ,
зелений – для іонів
,
зелений – для іонів
![]() ,
бурий колір має осад
,
бурий колір має осад
![]() .
Зробити висновок щодо впливу
.
Зробити висновок щодо впливу
![]() середовища на глибину перебігу
окисно-відновних процесів.
середовища на глибину перебігу
окисно-відновних процесів.
Питання для самоперевірки
1. Які реакції називаються окисно-відновними?
2. Що таке ступінь окиснення?
3. Що таке окисник і відновник?
4. Які сполуки мають окисно-відновну двоїстість?
5. Для яких реакцій використовують методи електронного та електронно-іонного балансів?
Лабораторна робота № 13
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Мета роботи - ознайомлення з роботою гальванічного елемента (ГЕ) і вивчення впливу природи електродів на величину ЕРС гальванічного елемента.
Загальні вказівки
Гальванічний елемент – це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну, причому електрони переходять від відновника до окисника не безпосередньо, а по зовнішньому провіднику (рис.4).
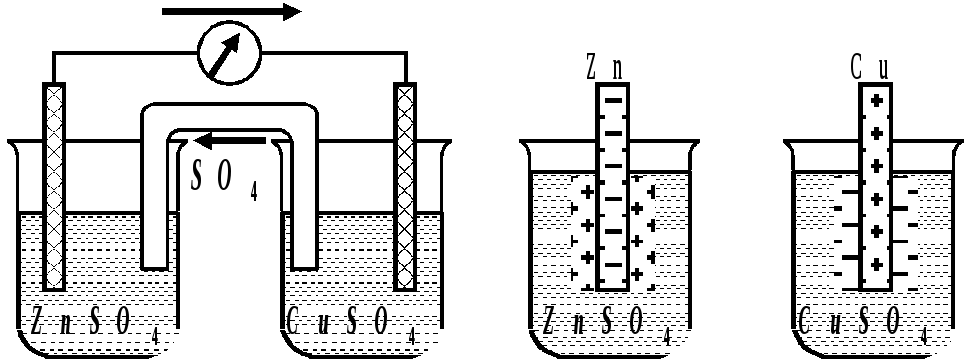
|
Рис. 4 |
Рис. 5 |
|
Схема гальванічного елемента |
Схема подвійного електричного шару |
Необхідно розуміти, що в
основі роботи ГЕ
лежать явища, що відбуваються на межі
поділу метал – розчин електроліту. Для
цього треба знати, що при зануренні
металу в розчин на межі метал – розчин
утворюється подвійний електричний шар
(рис. 5), що призводить до виникнення
стрибка потенціалу (електродний потенціал
(![]() ).
).
Величину електродного
потенціалу визначають за рівнянням
Нернста, яке для
![]() =
25 0С
має вигляд:
=
25 0С
має вигляд:
![]() ,
,
де
![]() - стандартний електродний потенціал;
- стандартний електродний потенціал;
![]() - число електронів, які віддає
метал;
- число електронів, які віддає
метал;
![]() -
концентрація іонів металу в розчині.
-
концентрація іонів металу в розчині.
Величину
![]() можна знайти в довідкових таблицях
(“ряд стандартних електродних
потенціалів”). Положення металу в ньому
характеризує його відновну здатність,
а також окисні властивості його іонів
у водних розчинах. Чим менше значення
можна знайти в довідкових таблицях
(“ряд стандартних електродних
потенціалів”). Положення металу в ньому
характеризує його відновну здатність,
а також окисні властивості його іонів
у водних розчинах. Чим менше значення
![]() ,
тим активніший метал, тим сильніші
відновні властивості виявляє він у
вигляді простої речовини. Так, метал,
який стоїть у ряду попереду, здатний
витиснути із сполук метали, які стоять
за ним.
,
тим активніший метал, тим сильніші
відновні властивості виявляє він у
вигляді простої речовини. Так, метал,
який стоїть у ряду попереду, здатний
витиснути із сполук метали, які стоять
за ним.
При складанні ГЕ треба знати, що більш активний метал завжди є анодом, а менш активний – катодом. При цьому необхідно пам’ятати, що на аноді відбуваються процеси окиснення (віддачі електронів), а на катоді – процеси відновлення (приєднання електронів).
Роботу ГЕрозглянемо на прикладі мідно-цинковогоГЕ(див. рис. 4). На межі поділу фаз виникає різниця потенціалів і встановлюється рівновага:

Потенціал цинкового електрода має більш негативне значення, ніж потенціал мідного, тому при замиканні зовнішнього ланцюга і при з’єднанні цинку з міддю металевим провідником електрони будуть переходити з цинкової пластини на мідну. У результаті цього рівновага на цинковому електроді зміститься праворуч, тому в розчин перейде додаткова кількість іонів цинку, в той же час рівновага на мідному електроді зміститься ліворуч і на ньому відбудеться осідання іонів міді з розчину у вигляді атомів.
Таким чином, цинковий електрод буде анодом, на ньому відбувається процес окиснення цинку, а мідний електрод буде катодом, на ньому відбувається процес відновлення іонів міді:
![]()
На внутрішній ділянці ланцюга
аніони
![]() переміщуються від мідного електрода
до цинкового, а катіони
переміщуються від мідного електрода
до цинкового, а катіони
![]() і
і
![]() в зворотному напрямку.
в зворотному напрямку.
Сумарний процес виражається рівнянням
![]()
Електрохімічні системи ГЕ зображують у вигляді схем, наприклад,
![]()
Ознайомившись з роботою гальванічного елемента, необхідно розрахувати його ЕРС за формулою:
ЕРС
=
![]() ,
,
де
![]() і
і
![]() - потенціал відповідно катода і анода.
- потенціал відповідно катода і анода.
Порядок виконання роботи
Зібрати мідно-цинковий,
залізо-цинковий і залізо-мідний ГЕ.
Для цього налити в склянки 0,01М розчини
![]() ,
занурити в них електроди з відповідного
металу і з’єднати попарно
розчини
,
занурити в них електроди з відповідного
металу і з’єднати попарно
розчини
![]() -
подібною трубкою, наповненою насиченим
розчином
-
подібною трубкою, наповненою насиченим
розчином
![]() у суміші з агар-агаром. З’єднати
електроди зібраного ГЕ
з вольтметром. Замкнути ланцюг і
відзначити напрямок струму (див. рис.
4). Зняти показання за шкалою вольтметра.
у суміші з агар-агаром. З’єднати
електроди зібраного ГЕ
з вольтметром. Замкнути ланцюг і
відзначити напрямок струму (див. рис.
4). Зняти показання за шкалою вольтметра.
Оформлення результатів роботи
1. Скласти схеми ГЕ. Вказати напрямок переміщення електронів по зовнішньому ланцюгу. Записати рівняння електродних процесів, скласти загальне рівняння реакції, що відображає роботу кожногоГЕ.
2. Розрахувати теоретичну
величину ЕРС
![]() кожного з досліджених елементів,
використовуючи рівняння Нернста.
кожного з досліджених елементів,
використовуючи рівняння Нернста.
Порівняти теоретичне значення ЕРС з експериментальним.
Зробити висновок щодо впливу природи електродів на величину ЕРС гальванічного елемента.
Питання для самоперевірки
1. Обчислити потенціал цинкового електрода, зануреного в 0,01 М розчин сульфату цинку; потенціал водневого електрода, зануреного в чисту воду при 25 0С і тиску 1 атм.
2. Скласти схеми роботи двох ГЕ, в одному з яких мідь була б анодом, а в іншому – катодом. Написати рівняння реакцій, що відбуваються при роботі цих елементів, і розрахувати ЕРС елементів у стандартних умовах.
3. Користуючись таблицею стандартних електродних потенціалів, відзначити, який з наведених нижче атомів та іонів може:
а) окиснюватися за допомогою
![]() :
:
![]()
б) відновлюватися за
допомогою
![]() :
:
![]() .
.
Скласти молекулярні та іонні рівняння можливих реакцій.
Лабораторна робота № 14
ЕЛЕКТРОЛІЗ
Мета роботи – ознайомлення з процесами, що відбуваються при електролізі водних розчинів солей.
Загальні вказівки
Необхідно чітко уявляти, що суть електролізу пов’язана з окисно-відновними процесами, що відбуваються на електродах при проходженні електричного струму через розплав або розчин електроліту. Як і в гальванічному елементі, на катоді відбуваються процеси відновлення, а на аноді – окиснення.
При розгляданні електролізу водних розчинів треба знати, що, крім іонів розчиненої речовини, в електродних процесах можуть брати участь молекули води.
Катодні процеси. Послідовність розрядження іонів залежить від значень електродних потенціалів. Чим менша величина стандартного електродного потенціалу, тим важче відновлюються його іони. Тому на катоді, в першу чергу, відновлюються катіони металів з найбільшим значенням електродних потенціалів. Необхідно відзначити, що потенціал водневого електрода при 250С у нейтральних розчинах (рН = 7) дорівнює (-0,41 В). Тому при електролізі водних розчинів солей найбільш активних металів (від Liдо Al), електродні потенціали яких значно менші ніж – 0,41 В, іони металу не відновлюються, а відновлюються іони водню або молекули води:
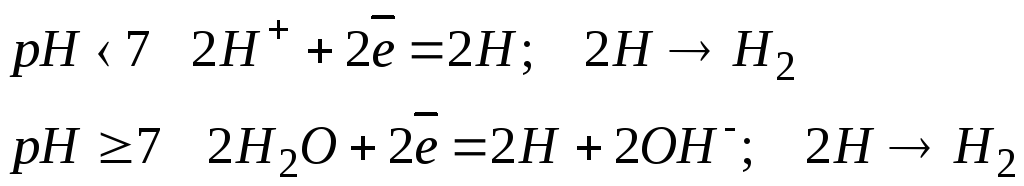
Іони металів, розташованих у ряді напруг між Аlі Pb, відновлюються одночасно з іонами водню, оскільки величина його потенціалу (- 0,41 В) близька до значень електродних потенціалів цих металів.
Катіони металів, розташованих у ряді напруг після водню, повністю відновлюються на катоді.
Анодні процеси. Процеси, що відбуваються на аноді, залежать як від електроліту, так і від матеріалу анода. Розрізняють розчинні (активні) аноди (Cu, Aq, Zn, Ni і др.) і нерозчинні (інертні). Наприклад: графіт, платина.
1. Розчинний анод. У цьому випадку окиснюється метал, з якого виготовлений анод:
![]()
Нерозчинний (інертний) анод. При наявності в розчині іонів
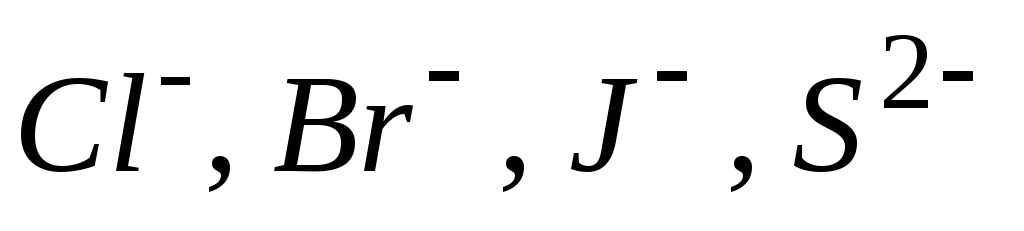 відбувається окиснення цих іонів.
Наприклад:
відбувається окиснення цих іонів.
Наприклад:
![]()
При наявності в розчині
аніонів кисневмісних кислот (наприклад,
![]() ),
а також фторид-іона
),
а також фторид-іона
![]() окиснення цих іонів не
відбувається, а виділяється кисень
завдяки електрохімічному окисненню
гідроксид-іонів та молекул води:
окиснення цих іонів не
відбувається, а виділяється кисень
завдяки електрохімічному окисненню
гідроксид-іонів та молекул води:
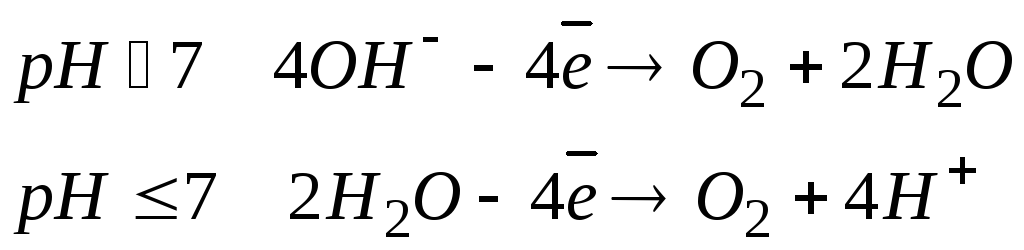
Порядок виконання роботи
Дослід. Електроліз водного розчину йодиду калію.
Налити в U-подібну трубку 5% розчин йодиду калію. Занурити в розчин вугільні електроди і підключити їх до джерела постійного струму. Додати в катодний простір декілька крапель фенолфталеїну, а в анодний – декілька крапель розчину крохмалю. Відзначити зміну кольору розчину біля кожного з електродів.
Оформлення результатів роботи
Скласти рівняння реакцій, що відбуваються біля електродів, визначити продукти, які утворюються в білякатодному і біляанодному просторі після завершення процесу електролізу.
Питання для самоперевірки
1. У воді розчинені солі алюмінію, цинку і міді. Визначити послідовність реакцій на катоді.
2. Скласти електронні рівняння
процесів, що відбуваються на електродах
під час електролізу водних розчинів
![]() :
:
а) у випадку вугільного анода;
б) у випадку мідного анода.
3. Скласти електронні рівняння
процесів, які відбуваються на електродах
при електролізі розчинів
![]() .
.
Лабораторна робота № 15
