
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Приклади виконання завдань
Приклад 1. З 4 г металу утворилось 6,632 г оксиду. Знайти молярну масу еквівалента металу.
Розв’язання. У 6,632 г оксиду міститься 4 г металу, а решта – кисень, маса якого становить
![]() (г).
(г).
Згідно з законом еквівалентів маємо:
![]() .
.
Звідки знаходимо:
![]() ,
,
![]() (г/моль),
(г/моль),
![]() (г/моль).
(г/моль).
Приклад
2. Знайти, в якій
кількості NaOH
міститься стільки ж моль еквівалентів,
скільки в 147 г
![]() .
.
Розв’язання.
![]() (г/моль).
(г/моль).
Кількість моль еквівалентів ν сірчаної кислоти в 147 г дорівнює:
ν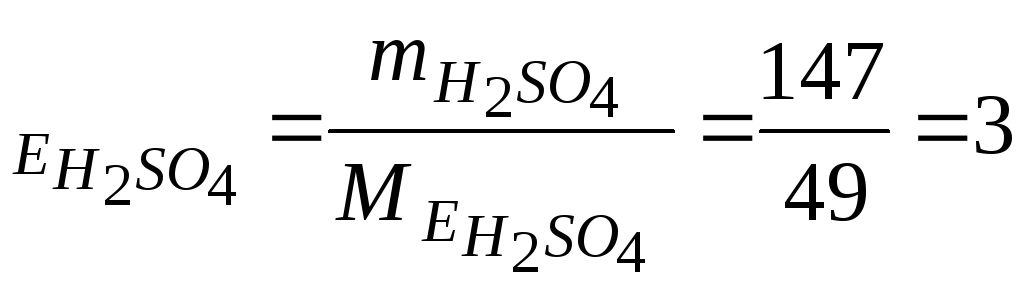 (моль екв).
(моль екв).
Оскільки
![]() (г/моль),
то
(г/моль),
то
маса 3 моль еквівалентів NaOH дорівнює:
![]() ,
,
![]() (г).
(г).
Приклад 3. Визначити тиск 3 л газу при деякій температурі, якщо за тієї самої температури тиск 5 л цього газу становить 60,8·103 Па.
Розв’язання. Згідно з законом Бойля-Маріотта при сталій температурі об’єм даної кількості газу обернено пропорційний тиску, під яким він знаходиться, тобто
![]() .
Звідси
.
Звідси
![]() Па.
Па.
Приклад 4. Визначити загальний тиск газів у посудині об’ємом 25 л, якщо в неї помістити 0,010 м3 етилену під тиском 60435 Па і 0,020 м3 метану під тиском 85670 Па.
Розв’язання.
Згідно з законом
Бойля-Маріотта
![]() визначаємо парціальні тиски кожного з
газів у посудині об’ємом 0,025 м3:
визначаємо парціальні тиски кожного з
газів у посудині об’ємом 0,025 м3:
![]() (Па).
(Па).
![]() (Па).
(Па).
Загальний тиск газової суміші дорівнює сумі парціальних тисків газів (закон Дальтона):
Рзаг=24174+68536=92710 (Па).
Приклад 5. Який об’єм за нормальних умов займе кисень масою 8 г?
Розв’язання.
Молярна маса кисню
![]() 32
г/моль. Знаходимо об’єм
кисню, користуючись наслідком із закону
Авогадро:
32
г/моль. Знаходимо об’єм
кисню, користуючись наслідком із закону
Авогадро:
32 г О2 займає об’єм 22,4 л
8 г х л
![]() (л).
(л).
Приклад 6. Знайти масу 50 л азоту (н.у.).
Розв’язання.
Молярна маса азоту![]() =
28 г/моль. Користуючись наслідком із
закону Авогадро, складаємо пропорцію:
=
28 г/моль. Користуючись наслідком із
закону Авогадро, складаємо пропорцію:
28 Г n2займають об’єм 22,4 л
х г N2 50 л
![]() (г).
(г).
Приклад
7. Визначити в грамах
масу молекули
![]() .
.
Розв’язання.
Молярна маса
![]() г/моль
г/моль
1 моль
![]() містить в собі 6,02·1023
молекул
містить в собі 6,02·1023
молекул
![]() .
.
Отже маса молекули
![]() дорівнює:
дорівнює:
![]() (г).
(г).
Приклад
8. Маса
![]() газу при 130С
і тиску 1,04·105
Па дорівнює 828
г..
Визначити молярну масу газу.
газу при 130С
і тиску 1,04·105
Па дорівнює 828
г..
Визначити молярну масу газу.
Розв’язання. Молярну масу газу можна визначити, користуючись рівнянням Менделєєва-Клапейрона:
![]()
Значення
універсальної газової сталої обираємо
у відповідності до одиниць вимірювання.
Якщо тиск виміряється в Па, а об’єм у
м3,
то
![]() Дж/моль·К.. Молярна маса газу дорівнює:
Дж/моль·К.. Молярна маса газу дорівнює:
![]() (г/моль).
(г/моль).
Приклад 9. Яка маса оксиду кальцію потрібна для утворення 49 г гідроксиду кальцію?
Розв’язання. Задача розв’язується на підставі рівняння хімічної реакції
![]() .
.
Оскільки
1 моль оксиду кальцію утворює 1 моль
гідроксиду кальцію, то враховуючи
молярні маси цих речовин
![]() г/моль,
г/моль,![]() г/моль, можна скласти пропорцію:
г/моль, можна скласти пропорцію:
5 6
г
6
г![]() 74 г
74 г![]() г
г
х г
г![]() 49 г
49 г![]()
Звідси:
![]() (г).
(г).
Отже, для одержання гідроксиду кальцію масою 49 г необхідно взяти 37,08 г оксиду кальцію.
Контрольні завдання
1. При окисненні 16,74 г двовалентного металу утворилося 21,54 г оксиду. Визначити молярну масу еквівалента металу. Чому дорівнюють молярна і атомна маси металу?
Відповідь: 27,9 г/моль.
2. В якій масі гідроксиду кальцію міститься стільки ж моль еквівалентів, скільки в 120 г гідроксиду натрію.
Відповідь: у 111 г.
3. При взаємодії 5,6 г заліза з сіркою утворилось 8,8 г сульфіду заліза. Визначити молярну масу еквівалента заліза, якщо молярна маса еквівалента сірки дорівнює 16 г/моль.
Відповідь: 28 г/моль.
4. Визначити масу 5 моль еквівалентів фосфату цинку.
Відповідь: 321 г.
5. Обчислити молярну масу еквівалента олова, якщо при нагріванні 0,92 г його у струмені кисню утворилось 1,17 г оксиду олова.
Відповідь: 29,4 г/моль.
6.
В якій масі ортофосфорної кислоти
міститься стільки ж моль еквівалентів,
скільки в 200 г
![]() .
.
Відповідь: у 130,4 г.
7. 0,432 г металу утворили 0,574 г хлориду. Обчислити молярну масу еквівалента металу, якщо молярна маса еквівалента хлору 35,5 г/моль.
Відповідь: 108 г/моль.
8. Скільки моль еквівалентів карбонату натрію міститься в 265 г цієї солі?
Відповідь: 5 моль екв.
9. При згорянні 5 г металу утворилось 9,44 г оксиду металу. Визначити молярну масу еквівалента металу.
Відповідь: 9,01 г/моль.
10. Визначити, з якою масою сірчаної кислоти будуть взаємодіяти 2 моль еквівалентів NaOH.
Відповідь: 98 г.
11. На нейтралізацію 2,45 г кислоти витрачено 2 г гідроксиду натрію. Визначити молярну масу еквівалента кислоти.
Відповідь: 49 г/моль.
12.
Для розчинення 16,8 г металу необхідно
14,7 г
![]() .
Визначити молярну масу еквівалента
металу і об’єм водню, що
віділився (н.у.).
.
Визначити молярну масу еквівалента
металу і об’єм водню, що
віділився (н.у.).
Відповідь: 56 г/моль;
3,36 л.
13.
Визначити молярну масу еквівалента
![]() у реакціях взаємодії його зNaOH
з утворенням:a)
у реакціях взаємодії його зNaOH
з утворенням:a)![]() ;б)
;б)
![]() .
.
Відповідь: а) 44 г/моль;
б) 22 г/моль.
14. Елемент утворює оксид, що містить 31,58% кисню. Визначити молярну масу еквівалента елемента.
Відповідь: 17,3 г/моль.
15. Молярна маса еквівалента металу дорівнює 56,2 г/моль . Визначити процентний вміст металу в його оксиді.
Відповідь: 87,54%.
16. Елемент утворює гідрид, що містить 8,87% водню. Визначити молярну масу еквівалента елемента.
Відповідь: 10,35 г/моль.
17. Маса 1 л кисню дорівнює 1,4 г. Скільки літрів кисню необхідно для згоряння 21 г магнію, молярна маса еквівалента якого дорівнює 12 г/моль.
Відповідь: 10 л.
18.
Обчислити масу 3 моль еквівалентів
![]() .
.
19.
При нагріванні 20 г металу одержали 21,66
г оксиду. Визначити молярну масу
еквівалента металу, якщо
![]() г/моль.
г/моль.
Відповідь: 96,3 г/моль.
20. Визначити молярну масу еквівалента цинку, знаючи, що маса його 0,1108 г витісняє з кислоти 38,08 мл водню (н.у.).
Відповідь: 32,6 г/моль.
21. Який об’єм займатиме кисень за нормальних умов, якщо при 200С та 110 кПа його об’єм становить 2,5 л?
Відповідь: 2,53 л.
22. В автомобільній шині об’ємом 0,1 м3 міститься повітря під тиском 200 кПа. Який об’єм повітря вийде з шини після відкриття клапану? Вважати, що зовнішні умови відповідають нормальним.
Відповідь: 0,097 м3.
23. Деякий об’єм газу взято за нормальних умов. При якій температурі тиск газу збільшиться вдвічі, якщо об’єм газу підтримувати постійним?
Відповідь: 273К.
24. При температурі 270С деяка кількість газу займає об’єм 1000 мл. Який об’єм займатиме газ при підвищенні температури на 1000С, якщо тиск газу підтримується сталим?
Відповідь: 1333 мл.
25. При температурі 270С деяка кількість газу займає об’єм 1000 мл. Який об’єм займатиме газ при зниженні температури на 500С, якщо тиск газу підтримувати сталим?
Відповідь: 833 мл.
26. Балон наповнили газом за нормальних умов. Яка частина газу залишиться в балоні, якщо його відкрити та одночасно підвищити температуру на 1000С?
Відповідь: 0,732.
27. Тиск газу в закритому балоні становить 400 кПа. Яку частину газу слід випустити з балону, щоб тиск газу зменшився до 150 кПа?
Відповідь: 0,625.
28. Який тиск потрібний для того, щоб зібрати в об’єм 10 м3 при деякій температурі оксид вуглецю (IV), якщо 5 м3 його знаходяться під тиском 1,99·106 Па при тій самій температурі?
Відповідь: 9,95·105 Па.
29. При температурі 150С тиск в балоні з азотом дорівнює 9,12 МПа. За якої температури тиск стане рівним 12,2 МПа?
Відповідь: 385 К.
30. Який об’єм займає метан масою 64 г при температурі 1100С і тиску 0,96·105 Па?
Відповідь: 132,6 л.
31. У балоні, який вміщує 12 л знаходиться кисень під тиском 15,2 МПа при 00С. Який об’єм займе газ за нормальних умов?
Відповідь: 180 л.
32. Повітря об’ємом 1 л знаходиться при температурі 170С та тиску 1,013·105 Па. Як зміниться об’єм, якщо повітря охолодити до (-75)0С за того ж тиску?
Відповідь: 0,68 л.
33. Тиск газу, що займає об’єм 2,5 л, дорівнює 121,6 кПа. Чому дорівнюватиме тиск, якщо не змінюючи температури стиснути газ до об ’єму в 1 л?
Відповідь: 303,9 кПа
34. Повітря об’ємом 1 л знаходиться при температурі 170С та тиску 1,013·105 Па. Як зміниться об’єм, якщо повітря підігріти до 750С при тому ж самому тиску?
Відповідь: 123 л.
35. Який об’єм кисню при
температурі 170С
і тиску 1,2·105
Па можна одержати при прожарюванні
хлорату калію
![]() масою 2,45 кг, в якому масова частка домішок
складає 2,5%.
масою 2,45 кг, в якому масова частка домішок
складає 2,5%.
Відповідь: 587 л.
36. Тиск повітря в автомобільній шині 0,3 МПа при 150С. Як зміниться тиск, якщо шина нагріється до 500С?
Відповідь: 0,34 МПа.
37. При температурі 150С тиск в балоні з киснем дорівнює 91,2·102 кПа. При якій температурі він буде дорівнювати 101,33·102 кПа?
Відповідь: 320К.
38. При температурі 170С деяка кількість газу займає об’єм 580 мл. Який об’єм займе та сама кількість газу при 1000С, якщо тиск залишиться незмінним?
Відповідь: 546 мл.
39. При температурі 270С і тиску 720 мм. рт. ст. об ’єм газу дорівнює 5 л. Який об’єм займе ця ж кількість газу при температурі 390С і тиску 104 кПа?
Відповідь: 4,8 л.
40. Який об’єм за нормальних умов займатимуть 200 мл водню, зібраного над водою при 220С і тиску 100 кПа, якщо тиск насиченої пари води дорівнює 2,6 кПа?
Відповідь: 178 мл.
41. Знайти масу 280 л водню (умови нормальні).
Відповідь: 25 г.
42. Який об’єм за нормальних умов займатиме хлористий водень масою 14,6 г?
Відповідь: 8,95 л.
43. Яка маса 200 л хлору при 00С і 760 мм.рт.ст.?
Відповідь: 663,93 г.
44. Визначити масу 1,8 л сірководню за нормальних умов.
Відповідь: 2,73 г.
45. Визначити, який об’єм займатимуть 5,25 г азоту за нормальних умов.
Відповідь: 4,2 л.
46. Який об’єм вуглекислого газу (н.у.) утвориться при згорянні 1 м3 метану?
Відповідь: 1000 л.
47. Який об’єм вуглекислого газу (н.у.) утвориться при згорянні 200 л етану?
Відповідь: 400 л.
48. Скільки молекул міститься в 1 мл будь-якого газу при 00С і 760 мм.рт.ст.?
Відповідь: 2,7·1019.
49. Маса 1 л газу за нормальних умов дорівнює 1,25 г. Визначити: а) молярну масу газу; б) масу молекули газу.
Відповідь: а) 28 г/моль
б) 4,6·10 -23 г.
50.
Знайти в грамах масу молекули
![]() .
.
Відповідь: 1,06·10-22 г.
51. В якій масі азоту міститься 1024 молекул?
Відповідь: 46,5 г.
52. В якому об’ємі хлору (н.у.) міститься 1020 молекул?
Відповідь: 3,72 мл.
53. Яку кількість молекул містить у собі 0,01 моль кисню? Яка маса молекули кисню?
Відповідь: 6,02·1021;
5,3·10-23 г.
54. Маса 5,6 л газу (н.у.) дорівнює 8,5 г. Визначити: а) молярну масу газу;
б) масу молекули газу.
Відповідь: а) 34 г/моль;
б) 5,6·10-23г.
55. У 5 л якого газу, кисню чи водню (н.у.), міститься більша кількість молекул?
56. Скільки молекул міститься в 1 л (н.у.) аміаку? Яка маса молекули аміаку?
Відповідь: 2,68·1022;
2,82·10-23г.
57. Скільки молекул
міститься в 4 л (н.у.) діоксиду вуглецю?
Яка маса молекули
![]() ?
?
Відповідь: 1,07·1023;
7,3·10-23г.
58. Яку кількість молекул містить в собі 0,1 моль водню? Яка маса молекули водню?
Відповідь: 6,02·1022;
3,3·10-24г.
59. Маса 11,2 л газу (н.у.) дорівнює 8 г. Визначити: а) молярну масу газу; б) масу молекули газу.
Відповідь: а) 16 г/моль;
б) 2,65·10-23 г.
60.
Який об’єм (н.у.) займатиме метан
![]() масою 160 г?
масою 160 г?
Відповідь: 224 л.
61. Визначити молярну масу газу, якщо 1,56 л його при температурі 270С та тиску 1,037·105 Па важить 2,86 г.
Відповідь: 44 г/моль.
62. Маса 1 дм3 повітря при 101,325 кПа та 200С дорівнює 1,205г. Визначити середню молярну масу повітря.
Відповідь: 29 г/моль.
63. Обчислити масу 25 дм3 водню при температурі 150С та тиску 810,4 кПа.
Відповідь: 16,92 г.
64. Об’єм гумової камери автомобільної шини становить 0,025 м3, тиск у ній 5,0665·105 Па. Визначити масу повітря, що знаходиться в камері, при 200С, якщо середня молярна маса повітря 29 г/моль.
Відповідь: 150,78 г.
65.
Визначити масу парів толуолу
![]() в приміщенні об’ємом 30 м3
при 250С,
якщо тиск парів толуолу за даної
температури становить 2972 Па.
в приміщенні об’ємом 30 м3
при 250С,
якщо тиск парів толуолу за даної
температури становить 2972 Па.
Відповідь: 3,3 кг.
66.
Визначити об’єм, який займатиме
![]() масою 5,5 г при температурі 110С
та тиску 770 мм рт.ст.
масою 5,5 г при температурі 110С
та тиску 770 мм рт.ст.
Відповідь: 2,875 л.
67. Визначити об’єм, який займатиме 0,1 г хлору при температурі 470С та тиску 0,2 атм.
Відповідь: 185 мл.
68. Оксид вуглецю (1V) перебуває в посудині, місткість якої 20 л, при температурі 220С і тиску 500 кПа. Визначити масу оксиду вуглецю.
Відповідь: 179,4 г.
69. Газ масою 30,3 г при температурі 180С заповнив посудину об’ємом 15 л. Тиск газу всередині становить 122 кПа. Визначити молярну масу газу.
Відповідь: 40 г/моль.
70. Визначити густину за воднем газоподібної речовини, 1 г якої при температурі 270С та тиску 770 мм рт.ст. займає об’єм 760 мл.
Відповідь: 16.
71.
Який об’єм при 210С
та 765 мм рт.ст.
займатиме водень, що необхідний для
перетворення 8,3 г
![]() у металічний нікель?
у металічний нікель?
Відповідь: 3,6 л
72. Знайти об’єм 3 г парів води при температурі 1030С та тиску 760 мм рт.ст.
Відповідь: 5,2 л.
73. Визначити масу азоту, що знаходиться у балоні ємністю 50 л під тиском 205 атм при температурі 270С.
Відповідь: 11,67 кг.
74.
У закритому балоні знаходиться 200 г
кисню під тиском 3,5 атм при температурі
70С.
Визначити масу
![]() у цьому ж балоні при тій самій температурі
під тиском 2,8 атм.
у цьому ж балоні при тій самій температурі
під тиском 2,8 атм.
Відповідь: 220 г.
75. Яка кількість кальцію вступила в реакцію з водою, якщо об’єм водню, що виділився в результаті реакції, при 250С та 745 мм рт. ст. становить 480 мл?
Відповідь: 0,77 г.
76. Балон ємністю 10 л вміщує при 270С 1 моль кисню. Визначити тиск кисню в балоні.
Відповідь: 2,46 атм.
77. Стальний балон для зберігання 50 л кисню розрахований на тиск до 1 МПа та температуру до 500С. Яку масу кисню можна помістити в цей балон?
Відповідь: 596 г.
78. Яка маса гелію, необхідна для заповнення оболонки аеростату, що має об’єм 4000 м3, при температурі 300С та тиску 120 кПа?
Відповідь: 1520 т.
79. Під яким тиском буде знаходитись водень, що утворився з 200 кг води при повному її розкладі, якщо помістити його у газгольдер ємністю 5 м3 при температурі -300С?
Відповідь: 4,5 МПа.
80. Скільки водню можна одержати з метану, що знаходиться в балоні ємністю 15 л при температурі 1700С та тиску 10 кПа?
Відповідь: 0,16 г.
81. Яка маса карбонату кальцію потрібна для одержання 22,4 кг оксиду кальцію?
Відповідь: 40,00 кг
82. При взаємодії сірки та заліза утворюється 285 г сульфіду заліза (II). Розрахувати, яку масу сірки було витрачено?
Відповідь: 103,64 г.
83. Яку масу міді можна одержати: а) з 20 г оксиду міді (I); б) з 10 г оксиду міді (II)?
Відповідь: а)17,76 г; б) 8 г.
84. Яку масу кухонної солі NaCl можна одержати з 750 г карбонату натрію?
Відповідь: 827,83 г.
85. Яка маса осаду утворюється, якщо до розчину, що містить 16,40 г нітрату кальцію додати розчин, що містить 12,72 г карбонату натрію?
Відповідь: 10 г.
86.
Яка маса природного вапняку з вмістом
карбонату кальцію 95% потрібна для
утворення 3 т негашеного вапна
![]() ?
?
Відповідь: 5,36 т.
87. Скільки грамів сірчаної кислоти може прореагувати з 14,4 г магнію? Який об’єм (н.у.) водню при цьому утворюється?
Відповідь: 5,88 г;
13,44 дм3.
88. Титан у промисловості одержують магнійтермічним методом:
![]()
Скільки грамів магнію потрібно взяти, щоб із хлориду титану (IV) одержати 19,2 кг титану?
Відповідь: 19,2 кг.
89. Яка маса оксиду міді (II) потрібна для одержання 645 г міді?
Відповідь: 807,5 г.
90.
Який об’єм ацетилену
![]() (н.у.) можна одержати з 3 кг карбіду кальцію
(н.у.) можна одержати з 3 кг карбіду кальцію![]() ?
?
Відповідь: 1050 л.
91. Яка маса брому потрібна для одержання броміду алюмінію масою 93,7 г?
Відповідь: 84,21 г.
92. У колбу з водою помістити 93 г кальцію. Який об’єм (н.у.) водню утворюється?
Відповідь: 52,08 л.
93. Яка маса оксиду калію потрібна для утворення 165,5 г гідроксиду калію?
Відповідь: 138,95 г.
94.
Внаслідок випалювання магнезиту
![]() утворюється оксид магнію. Яка маса
утворюється оксид магнію. Яка маса![]() потрібна для одержання 985 г
потрібна для одержання 985 г![]() ?
?
Відповідь: 206,85 г.
95.
Внаслідок нагрівання концентрованої
сірчаної кислоти з хлоридом натрію
утворюється хлороводнева кислота. Яка
маса
![]() потрібна для одержання 178,3 г хлороводневої
кислоти?
потрібна для одержання 178,3 г хлороводневої
кислоти?
Відповідь: 285,77 г.
96. При нагріванні кальцію в повітрі утворюється оксид кальцію. Яка маса кальцію потрібна для одержання 276,5 г СаО?
Відповідь: 197,5 г.
97. Внаслідок взаємодії цинку з сірчаною кислотою утворюється водень. Яка маса цинку потрібна для одержання 247,5 л водню?
Відповідь: 722,61 л.
98.
При випалюванні мінералу кальциту
![]() утворюється оксид кальцію. Яка маса
кальциту потрібна для одержання 436 г
оксиду кальцію?
утворюється оксид кальцію. Яка маса
кальциту потрібна для одержання 436 г
оксиду кальцію?
Відповідь: 778,57 г.
99.
Для добування олова олов’яну
руду
![]() відновлюють вугіллям. Яка маса руди
потрібна для одержання 537,5 г олова?
відновлюють вугіллям. Яка маса руди
потрібна для одержання 537,5 г олова?
Відповідь: 682,4 г.
100.
Оксид заліза (II)
одержують термічним розкладом карбонату
заліза. Яка маса
![]() потрібна для утворення 274 г оксиду
заліза?
потрібна для утворення 274 г оксиду
заліза?
Відповідь: 441,44 г.
