
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Деякі основи та їхні залишки
|
Основа |
Залишок основи | ||
|
Формула |
Назва |
Формула |
Назва |
|
|
Гідроксид натрію |
|
Натрій- іон |
|
|
Гідроксид магнію |
|
Гідроксомагній-іон |
|
|
Магній-іон | ||
|
|
Гідроксид феруму (Ш), гідроксид заліза (Ш), тригідроксид заліза
|
|
Дигідроксозалізо(Ш)-іон, дигідроксоферум(Ш) |
|
|
Гідроксозалізо(Ш)-іон, гідроксоферум (Ш), | ||
|
|
Залізо(Ш)-іон Ферум(Ш)-іон | ||
Кислотами (кислотними гідроксидами) називають сполуки, що містять у молекулах атоми водню, здатні заміщуватися на атоми металів з утворенням солей.
З точки зору теорії
електролітичної дисоціації кислоти –
це сполуки, які під час дисоціації здатні
відщеплювати катіони лише одного типу
-
![]() .
.
Негативні іони, які утворюються в результаті відриву від молекули кислоти одного або кількох іонів водню, називаються кислотними залишками. Значення негативного заряду іона кислотного залишку визначається числом іонів водню, що відірвалися. Наявність атомів водню в кислотних залишках позначається словом “гідро” або “гідроген” з відповідним префіксом.
За числом атомів водню в
молекулі кислоти, здатних заміщуватися
на метал з утворенням солей, розрізняють
кислоти одноосновні (наприклад, азотна
кислота
![]() ),
двохосновні (сірчиста кислота
),
двохосновні (сірчиста кислота
![]() ,
вугільна
,
вугільна
![]() ),
трьохосновні (ортофосфорна
),
трьохосновні (ортофосфорна
![]() ).
).
За наявністю кисню у складі
молекул кислоти поділяються на кисневмісні
(наприклад,
![]() ,
,
![]() )
і безкисневі (наприклад,
)
і безкисневі (наприклад,
![]() ).
).
Назви деяких кислот та їхніх кислотних залишків наведені в таблиці 1.2.
Таблиця 1.2
Деякі кислоти та їхні залишки
|
Кислота |
Кислотний залишок | |||
|
Формула |
Назва |
Формула |
Назва | |
|
|
Хлороводнева, хлоридна, соляна |
|
Хлорид-іон | |
|
|
Бромоводнева, бромідна |
|
Бромід-іон | |
|
|
Йодоводнева, йодидна |
|
Йодид-іон | |
|
|
Фтороводнева, фторидна |
|
Фторид-іон | |
|
|
Ціанистоводнева, ціанідна |
|
Ціанід-іон | |
|
|
Сірководнева, Сульфідна |
|
Гідросульфід-іон, гідрогенсульфід-іон | |
|
|
Сульфід-іон | |||
|
|
Азотна, нітратна |
|
Нітрат-іон | |
|
|
Азотиста, нітритна, нітратна (Ш) |
|
Нітрит-іон | |
|
|
Сірчана, сульфатна |
|
Гідросульфат-іон, гідрогенсульфат-іон
| |
|
|
Сульфат-іон
| |||
|
|
Сірчиста, сульфітна, сульфатна(IV) |
|
Гідросульфіт-іон, гідрогенсульфіт-іон | |
|
|
Сульфіт-іон, сульфат (1V)-іон | |||
|
|
|
|
| |
|
Продовження табл. 1.2 | ||||
|
|
Вугільна, карбонатна |
|
Гідрокарбонат-іон, гідрогенкарбонат-іон | |
|
|
Карбонат-іон | |||
|
|
Кремнієва, силікатна |
|
Гідросилікат-іон, гідрогенсилікат-іон | |
|
|
Силікат-іон | |||
|
|
Ортофосфорна, ортофосфатна |
|
Дигідрофосфат-іон, дигідрогенфосфат-іон | |
|
|
Гідрофосфат-іон, гідрогенфосфат-іон | |||
|
|
Фосфат-іон, ортофосфат-іон | |||
|
|
Марганцева, перманганатна |
|
Перманганат-іон, манганат(VП)-іон | |
|
|
Оцтова, ацетатна |
|
Ацетат-іон | |
Характерними властивостями кислот є їхня здатність взаємодіяти з основами і основними оксидами з утворенням солей:
![]()
Амфотерні гідроксиди ― це гідроксиди, які виявляють основні та кислотні властивості залежно від умов – тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії.
До амфотерних гідроксидів
належать гідроксиди деяких металів
головних підгруп (![]() ),
а також багатьох металів побічних
підгруп періодичної системи елементів
у проміжних ступенях окиснення:
),
а також багатьох металів побічних
підгруп періодичної системи елементів
у проміжних ступенях окиснення:![]()
![]() .
.
При взаємодії з кислотами амфотерні гідроксиди виявляють властивості основ, а при взаємодії з основами – властивості кислот:
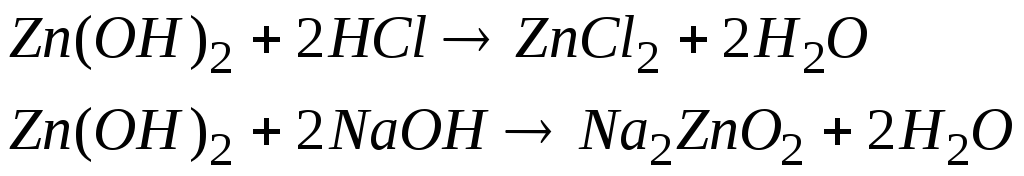
Назви амфотерних гідроксидів
утворюються подібно до назв основ:
![]() -
гідроксид цинку.
-
гідроксид цинку.
Солі можна розглядати як продукти повного або часткового заміщення атомів водню (гідрогену) у кислотах на атоми металів, або як продукти повного чи часткового заміщення гідроксильних груп в основах на кислотні залишки.
Розрізняють такі типи солей: нормальні або середні, кислі та основні.
Нормальні солі – це продукти повного заміщення атомів водню на атоми металу в молекулах кислот:
![]()
Кислі солі – це продукти неповного заміщення атомів водню на атоми металу в молекулах кислот:
![]()
Основні солі – це продукти неповного заміщення гідроксильних груп у молекулі багатокислотної основи або амфотерного гідроксиду на кислотні залишки:
![]()
Можна вважати, що солі утворені із залишків основ і залишків кислот.
За міжнародними номенклатурними
правилами назва солі складається з
назви металу та латинської назви
кислотного залишку. Наприклад,
![]() –
сульфат натрію або натрій сульфат.
–
сульфат натрію або натрій сульфат.
У назві кислих солей до
латинської назви аніона додають
числівник, що відповідає числу атомів
водню в молекулі кислоти і слово
“гідроген”- або “гідро”-, або “дигідро”.
Наприклад,
![]() - гідрофосфат натрію,
- гідрофосфат натрію,
![]() -
дигідрофосфат натрію.
-
дигідрофосфат натрію.
Аналогічно до назви катіона
основної солі додають слово “гідроксо”-,
наприклад:
![]() -
нітрат гідроксоалюмінію,
-
нітрат гідроксоалюмінію,
![]() - нітрат дигідроксоалюмінію.
- нітрат дигідроксоалюмінію.
Порядок виконання роботи
Дослід 1. Змінення забарвлення індикаторів у розчинах кислот і лугів.
Налити в три пробірки дистильовану воду і по краплях добавити розчин лакмусу до появи помітного забарвлення. В першу пробірку добавити кілька крапель кислоти, в другу – лугу, третя пробірка – контрольна. Спостерігати змінення забарвлення індикатора лакмусу.
Такий самий дослід провести з індикаторами метилоранжем, фенолфталеїном.
Заповнити таблицю:
|
Індикатор |
Забарвлення індикатора | ||
|
у воді |
у кислоті |
у лузі | |
|
Лакмус Метилоранж Фенолфталеїн |
|
|
|
Дослід 2. Одержання і властивості кислот.
1. Взаємодія кислоти з сіллю.У пробірку насипати невелику кількість сухого ацетату натрію і змочити розбавленим розчином сірчаної кислоти. За запахом визначити, яка речовина утворилась. В отвір пробірки, не торкаючись до стінок, внести лакмусовий папірець. Що при цьому спостерігається?
2. Взаємодія кислот з металами.У три пробірки налити розчини сірчаної, соляної та оцтової кислот. У кожну пробірку опустити по кілька гранул цинку. Спостерігати виділення газу.
Дослід 3. Одержання і властивості основ.
1. Взаємодія гідроксидів з солями.У три пробірки налити невеликі кількості розчинів сульфату міді (П), хлориду заліза (Ш) і сульфату заліза (П). До розчинів добавити такі самі об’єми 10%-го розчину гідроксиду натрію. Відмітити забарвлення осадів, що при цьому утворились.
2. Реакція гідроксиду міді (П).Гідроксид міді (П) з попереднього досліду вмістити у дві пробірки. В одну з них долити розчин сірчаної кислоти і перемішати, а іншу пробірку нагрівати до появи чорного осаду.
Оформлення результатів роботи
Дослід 1.Написати рівняння електролітичної дисоціації кислоти і лугу. Які іони зумовлюють зміну забарвлення індикатора?
Досліди 2,3. Написати рівняння реакцій.
Питання для самоперевірки
Визначити характер оксидів:
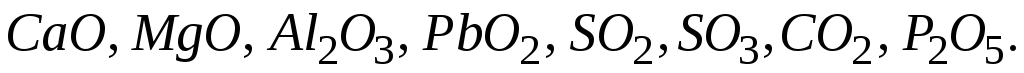
Які з них будуть взаємодіяти між собою? Написати рівняння відповідних реакцій.
Скласти формули вищих оксидів сірки, алюмінію, марганцю, азоту, кремнію. Назвати ці оксиди.
Як одержати, виходячи з соляної кислоти: а) хлорид натрію, б) хлорид магнію, в) хлорид гідроксокальцію, г) хлорид дигідроксоалюмінію? Написати рівняння реакцій.
З якими з перелічених речовин взаємодіє
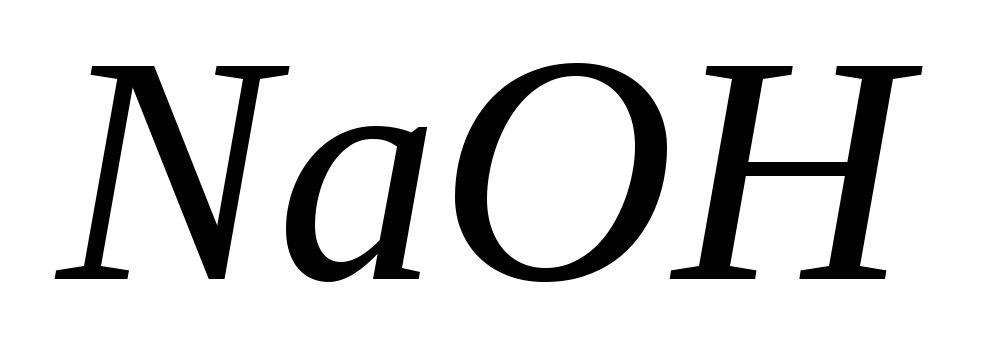 :
оксид кальцію, оксид сірки (IV),
сірчана кислота, оксид алюмінію? Написати
рівняння відповідних реакцій.
:
оксид кальцію, оксид сірки (IV),
сірчана кислота, оксид алюмінію? Написати
рівняння відповідних реакцій.Написати рівняння реакцій таких перетворень:
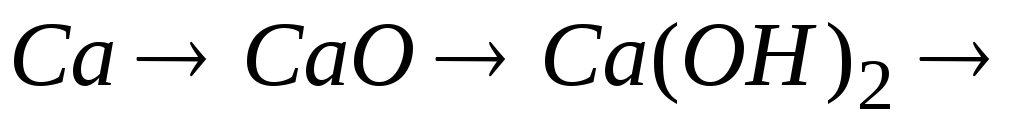
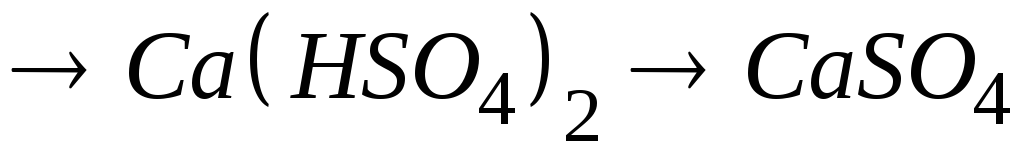 .
.
